Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Evaluations of phylogenetic proximity in a group of 67 dogs with
osteosarcoma: a pilot study
Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Canine Periosteal Osteosarcoma
Images added / Abbildungen hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
New subcategory added / Neue Unterkategorie hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
Images added / Abbildungen hinzugefügt 01.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Heart valvular diseases



Etablierung eines kryochirurgischen Behandlungsverfahrens an Knochengewebe mittels Miniaturkryosonden und erste klinische Ergebnisse bei Osteosarkomen


Inhaltsverzeichnis
1 Einleitung
1.1 Vorwort
1.2 Ziel der Arbeit
1.3 Wahl des Versuchstieres
1.4 Versuchskriterien
1.5 Geschichtliches
1.5.1 Entwicklung der Kryochirurgie
1.5.2 Experimentelle Studien
1.5.3 Klinische Anwendung
1.6 Einführung in die Kryochirurgie
1.6.1 Physikalische Vorgänge bei der Kryochirurgie
1.6.1.1 Friereigenschaften von reinem Wasser
1.6.1.2 Der Gefrierpunkt
1.6.1.3 Die Kristallisation
1.6.1.4 Friereigenschaften von Lösungen
1.6.2 Grundlagen der Kryochirurgie (Gage, 1998; Baust, 1998)
1.6.2.1 Unmittelbare Zellschädigung
1.6.2.2 Verzögerte Zellschädigung
1.6.3 Die kryochirurgische Technik
1.6.3.1 Die Frierrate
1.6.3.2 Die Gewebetemperatur
1.6.3.3 Die Frierzeit
1.6.3.4 Die Taurate
1.6.3.5 Die Wiederholung des Frier-Tau-Zyklus
1.6.4 Funktionsweise von Kryogeräten
1.6.4.1 Kühlmittel
1.6.4.2 Möglichkeiten der Kälteerzeugung
1.6.4.3 Temperaturregistrierung
1.7
Aufbau moderner Kryotherapiegeräte
1.7.1 Basiseinheit
1.7.2 Aufbau der Kryosonden
1.7.3 Aufbau des Erbe-Cryo 6
1.8 Stabilitätsprüfungen
2 Tiere, Materialien und Methoden
2.1 Versuchsaufbau und Durchführung
2.2 Operationsdurchführung
2.2.1 Femur
2.2.2 Tibia
2.3 Magnetresonanztomographie
2.4 Röntgendiagnostik
2.5 Testung der biomechanischen Belastbarkeit
2.6 Histologie
2.6.1 Knochenmarker
2.6.2 Trenn-Dünnschliff-Technik (Sandwich-Technik) nach Donath und Breuner(1989)
2.7 Stabilitätsprüfung
2.7.1 Versuchsaufbau
2.7.1.1 Mechanische Prüfung der Femora
2.7.1.2 Mechanische Prüfung der Tibiae
2.7.2 Statistik
3
Ergebnisse
3.1 Stabilitätsprüfung
3.2 Histologie
3.2.1 Histologische Auswertung
3.2.1.1 2-Monats-Gruppe – Femur
3.2.1.2 2-Monats-Gruppe – Tibia
3.2.1.3 4-Monats-Gruppe – Femur
3.2.1.4 4-Monats-Gruppe – Tibia
3.2.1.5 6-Monats-Gruppe – Femur
3.2.1.6
6-Monats- Gruppe – Tibia
3.3 Praktische Anwendung der Kryochirurgie zur Behandlung eines Osteosarkoms –Fallberichte
3.3.1 Fallbericht 1
3.3.2 Fallbericht 2
3.3.3 Fallbericht 3
4 Diskussion
4.1 Histologie
4.2 Fallbeispiele
5 Zusammenfassung
6 Hinweise
6.1 Hinweis auf Teilpublikation
6.2 Beurteilung Histologie Fallbericht 1
7
Literatur
8 Abkürzungsverzeichnis
1 Einleitung
1.1 Vorwort
Das Gebiet der Kryochirurgie ist in zahlreiche medizinische Therapien zumeist alsunterstützende Therapieform eingeflossen. Die Möglichkeiten, mittels Kälteunterschiedlichste Krankheiten behandeln und heilen zu können, sind vielfältig. Um soerstaunlicher ist es, dass die Kryobehandlung nur von sehr wenigen Chirurgen undOrthopäden als
Therapieform eingesetzt wird und das Forschungsbedürfnis auf diesem Feldsehr groß ist.
Besonders, wenn alternative Therapieformen fehlen oder ohne Kältebehandlung nurradikalchirurgische Eingriffe zur Heilung oder palliativen Versorgung vorgenommen werdenkönnen, ist die Kryochirurgie eine zusätzliche Möglichkeit, die Lebensqualität der Patientenzu verbessern. So ist es möglich, durch die Knochenkryochirurgie Amputationen zuvermeiden und damit die distal der Erkrankung gelegenen, gesunden Skelettabschnitte zuerhalten. Im Idealfall ist es möglich, Knochentumore in situ zu zerstören, dabei dasGrundgerüst des Knochens zu erhalten und als Korpus für den Neuaufbau vonKnochengewebe zu verwenden.
1.2 Ziel der Arbeit
Ziel dieser Arbeit ist die Erprobung neuester kryochirurgischer Verfahren in geschlossenenSystemen mit neuartigen Miniaturkryosonden am Knochengewebe unter besondererBerücksichtigung der Veränderung der Knochenstabilität im zeitlichen Verlauf sowie dieErarbeitung histologischer Verlaufskriterien.
Das herkömmliche Verfahren der Vereisung am Knochen bestand in einem offenen System.Hierbei wurde flüssiger Stickstoff in die Knochenhöhle gegossen oder gesprüht.Zwangsläufig ergab sich durch die mangelhafte Steuerbarkeit ein Verlust von vitalemKnochengewebe. Die Stabilität des Knochens wurde unnötig geschwächt.
Bei der Verwendung eines geschlossenen Systems
älterer Bauart mit Kryosonde wurde dieSteuerbarkeit zwar erheblich verbessert, jedoch war die
iatrogene Schwächung des Knochensbeim Einbringen der Sonde erheblich, da die Sondengröße im
Vergleich zur Kühlleistungeinen großen Durchmesser in Anspruch nahm.
Bei den von uns verwendeten neuartigen Miniaturkryosonden ist der Durchmesser der
Sondeund korrespondierend dazu der Kortikalisdefekt beim Einbringen deutlich geringer. Zudem
istder Gefriervorgang durch die hohe spezifische Frierleistung und extrem schnelle
Abkühlungdieser Sonden exakt steuerbar.
Im Tierversuch sollte der Erfolg der kryochirurgischen Behandlung, der Zeitverlauf
derHeilung und die damit verbundene mögliche Bruchgefährdung untersucht werden. DemKnochengewebe kommt als Zielorgan entscheidende Bedeutung zu, da die Lebensqualität derPatienten durch Vermeidung von Amputationen sowohl in physischer als auchpsychologischer Hinsicht entscheidend verbessert wird. Die Funktion betroffenerExtremitäten kann, im Gegensatz zu anderen Methoden, vollständig wiederhergestellt werdenoder sie ist zumindest nur in geringerem Umfang eingeschränkt. Die Amputation vonGliedmaßen als therapeutische oder palliative Maßnahme stellt sowohl funktionell als auchmental eine große Belastung für den Patienten dar.
Weiterhin sollten histologische Kriterien zur Beurteilung gesunden Knochengewebes nachkryochirurgischer Behandlung erarbeitet werden, um später das Randgebiet eines abladiertenTumors histologisch besser beurteilen zu können. Zusätzlich werden erste klinischeErgebnisse nach Kryoablation von Osteosarkomen vorgestellt.
1.3 Wahl des
Versuchstieres
Im
Vorfeld musste überlegt werden, inwieweit es möglich und durchführbar ist, ein möglichstgenaues
und auf den Menschen (oder auch das Tier) übertragbares Modell zu entwickeln, umgenaue Aussagen
über Vor- und Nachteile sowie Risiken dieser Methode treffen zu können.Um eine möglichst hohe
Übereinstimmung zwischen Human- und Tiergewebe zu erreichenund gleichzeitig die Durchführbarkeit
des Experiments zu gewährleisten, wurden Schafe alsVersuchstiere gewählt. Die Wahl fiel aufgrund
der ähnlichen biomechanischen Statik und derFestigkeit des Knochengewebes auf ein größeres
Säugetier. Experimentelle Studien an Rattenund Kaninchen liegen vor, jedoch treten sie als
Vergleichsmodell zum Menschen oderanderen großen Säugetieren aufgrund ihrer unterschiedlichen
Biostatik und Biomechanik desKnochens in den Hintergrund.
Andere, dem Menschen ähnliche Säuger wie Schweine wurden aufgrund mangelnder odererschwerter Zugangsmöglichkeit zum Knochen ausgeschlossen. Da die Tiere über einen Zeitraum von 6 Monaten versorgt und behandelt werden mussten, erschien sowohl ausKostengründen als auch aus Gründen der Handhabbarkeit das Schaf als ideales Versuchstier.
1.4
Versuchskriterien
Ein
Hauptaspekt ist die sichere Abtötung des zu operierenden Gebietes in vivo und dessenNachweis.
Mittels immunhistochemischer Bestimmung der Apoptose sollte im Rahmen eineranderen Dissertation
bewiesen werden, dass das betroffene Gebiet sicher zerstört werdenkann. Die Ergebnisse dieser
Arbeit sind z. Z. zur Publikation eingereicht.
Des Weiteren bestand ein Hauptaugenmerk auf der Wiedererlangung des
Ursprungszustandes.Hierzu wurde die Regenerationsfähigkeit des kryochirurgisch veränderten
Gewebes verfolgtund die Belastbarkeit des Knochens im Vergleich zum unbehandelten Knochengewebe
inverschiedenen Zeitintervallen bestimmt. Mittels Fluorochrommarkierungen können dieRegenerationsstadien histologisch aufgearbeitet und zeitlich eingegrenzt werden.
Im Ergebnisteil werden drei Fallbeispiele vorgestellt. Es handelt sich in allen Fällen
umHunde mit Osteosarkomen; zwei Tiere mit Osteosarkom im Bereich des distalen Radius
undein Tier mit Osteosarkom am distalen Femur. Eine konventionelle Behandlung derOsteosarkome durch Amputation wurde vom Besitzer abgelehnt und die Einwilligung zurexperimentellen kryochirurgischen Behandlung gegeben. In einem Fall wurde im Anschlussan die kryochirurgische Behandlung eine Radio-Chemotherapie eingeleitet.
Im Bereich der Komplikationen wurde die Gefahr der Thromboembolien vor allem imLungengewebe näher untersucht. Im direkten Umfeld der gesetzten Läsion wurde der Einflussauf das umliegende Muskel- und Nervengewebe sowie auf das hämodynamische Systemfestgestellt. Durch Kernspinanalyse wurden das Aufkommen von Ödemen und das Verhaltendes Knochenmarks im Wundgebiet registriert. Die Ergebnisse dieser Teilaspekte sind Teileiner anderen Dissertation und wurden bereits publiziert.
1.5 Geschichtliches
1.5.1 Entwicklung der Kryochirurgie
Das Ziel,
Kälte therapeutisch zu nutzen, geht zurück bis ins 19. Jahrhundert. 1807 wurdeerstmals von
Dominique Jean Larrey, Napoleons Leibarzt, über schmerzfrei durchgeführte Amputationen von Gliedmaßen während des Winterfeldzuges unter kaltenWitterungsbedingungen berichtet (Larrey, 1832).
Erst ein knappes halbes Jahrhundert später wurde von James Arnott über die Kältetherapie inder Krebsbehandlung berichtet. Er behandelte Uterus- und Mammakarzinome durch direktenKontakt eines Eisgemisches mit der Tumoroberfläche. Dabei beobachtete er sowohl eineSchmerz- als auch eine Massenreduktion des Gewebes (Arnott, 1851).
Über die
Jahre entwickelten sich die ersten Kältesysteme, die es möglich machten, Gewebegezielt zu
behandeln. Dabei handelte es sich um halboffene Systeme, bei denen dasKühlmittel in direktem
Kontakt mit dem Gewebe stand.
Die ersten Kryosonden wurden 1901 von White erfunden, der Aluminiumzylinder, die mitflüssiger Luft gefüllt waren, in das Tumorgewebe einführte (White, 1901).
Ebenfalls 1901 wurde es durch Dewar erstmals möglich, Kühlflüssigkeiten über einengewissen Zeitraum mittels vakuumisolierter Behälter zu lagern.
Das erste
halbgeschlossene Kryosystem, in dem die Kryosonden erstmals mittels eineszirkulierenden
Eisgemisches gekühlt wurden, erfand Fay (Fay, 1959).
Erst 1961 entwickelte Tytus (1961) das erste geschlossene Kühlsystem unter Verwendungvon Freon. Im gleichen Jahr stellten Cooper und Lee ihr erstes geschlossenes Kryosystemunter Verwendung von flüssigem Stickstoff vor, wie es vom Prinzip her auch heute nochverwendet wird (Cooper und Lee, 1963). Dabei wird die Kryosonde mittels einesvakuumisolierten Schlauches aus einem Stickstofftank gespeist und dabei auf -190° Cabgekühlt.
Die
nachfolgende Tabelle gibt einen Überblick über die historische Entwicklung derKryochirurgie
(Tabelle 1).

Besonders bei der Bekämpfung von Tumoren im Kiefer- und Gesichtsbereich wurde die
Kryochirurgie in den zurückliegenden Jahren eingesetzt, so dass viele Arbeiten zur
Grundlagenforschung sowie klinischen Anwendung aus dem Mund-, Kiefer- und
Gesichtschirurgischen Fachgebiet stammen.
Häufige Anwendung scheint die Kryochirurgie ebenfalls im russischsprachigen Raum zu
finden, was zahlreiche wissenschaftliche Veröffentlichungen belegen. Aufgrund von
Schwierigkeiten bei der russischen Übersetzung sind die Forschungsergebnisse leider nicht
leicht verfügbar, so dass im Überblick nur die gängige englischsprachige Literatur genutzt
werden konnte.
1.5.2 Experimentelle Studien
Gage und Emmings (1967) führten erste Frierungen an Unterkiefer- und Femurknochen von
Kaninchen durch. Dabei verwendeten sie einen spiralartig um den Knochen gelegten
Schlauch, durch den flüssiger Stickstoff geleitet wurde. Die auf diese Weise behandelte
Knochen bildeten im Verlauf von etwa 1 Woche eine uniforme Knochennekrose mit scharfer
Demarkation zum Gesunden im Bereich der 0° C-Grenze aus. Schon wenige Tage später kam
es dann zu einer reparativen Knochenneubildung, ausgehend von vitalem Knochen und
Periost an der Grenze des kryochirurgisch behandelten Segments zum Gesunden. Nach einem
Monat fand sich histologisch bereits eine dünne, subperiostal gelegene Schicht aus
trabekulärem Knochen, die das gesamte avitale Knochensegment überzog. Nach 4 Monaten
war das gesamte avitale Gewebe abgebaut und durch Wachstum der trabekulären
Knochenschicht durch Kompaktknochen ersetzt. Die Dauer der Umbauvorgänge nahm
insgesamt ein Jahr in Anspruch.
Hausamen et al. (1973) führten Frierversuche an Rattenkiefern und Tibiaknochen von
Kaninchen durch. Bereits nach 2 Wochen konnten röntgenologisch Veränderungen der
Knochensubstanz in Form von Periostverdickungen an den Enden der gefrorenen Segmente
dargestellt werden, die sich im weiteren Verlauf über das gesamte Segment erstreckten. Die
Kortikalis des kryobehandelten Knochens blieb zunächst über die ersten 4 Wochen
unverändert, um dann im weiteren Verlauf, ausgehend von subperiostalen Resorptionszonen,
über einen Zeitraum von 8 Wochen komplett durch neuen Knochen ersetzt zu werden.
Gage et al. (1966) berichteten zuvor bereits über ähnliche radiologische Veränderungen bei
der Frierung von Hundefemora, deren Heilung sich über 6 Monate hinzog.
Kuylenstierna et al. (1981) berichteten nach mikroangiografischen Untersuchungen an
Unterkieferknochen von Kaninchen bereits nach 30 Minuten nach Kryobehandlung von einer
Stase der Blutversorgung im betroffenen Gebiet, welche sich in Kürze weiter ausbreitete und
nach 48 Stunden auch die umliegenden Weichteile mit einbezog. Daraus wurde gefolgert,
dass die Ischämie einen wesentlichen Bestandteil in der Ausbildung der Kryonekrose
darstellt. Zwei Wochen nach Behandlung begann die Rekanalisation der Havers Kanäle
ausgehend von in den Markraum einsprießenden Gefäßen. In weiteren Studien stellten die
Autoren mittels Fluorochrommarkierung des Knochens die Regenerationsfähigkeit des
ossären Gewebes dar. Die Revitalisierung ging im Wesentlichen übereinstimmend mit den
Mikroangiographiebefunden von der Markraumseite des Knochens aus und ereichte ihr
Maximum zwischen der 4. und 8. Woche post OP.
Da Umbauvorgänge an Knochen zwangsläufig Änderungen der Biomechanik des behandelten
Gewebes nach sich ziehen, ist es von großer Bedeutung, Untersuchungen über die
Knochenstabilität nach derartigen Eingriffen durchzuführen.
Fisher et al. (1978) belegten in Studien an Rattenunterkiefern eine maximale Reduktion der
Knochenstabilität von etwa 30%, gemessen am Ausgangswert 8 Wochen nach
kryochirurgischer Behandlung. Eine vollständige Stabilität konnte 4 Monate post OP wieder
erreicht werden.
Auch Gage et al. (1966) zeigten, dass das Auftreten von Spontanfrakturen in einer
Hundestudie zum Zeitpunkt der maximalen Knochenumbauvorgänge nach Ablauf des 2.
Monats am höchsten war.
Bradley et al. (1975) definierten drei wesentliche Phasen als Reaktion des Knochens auf
Kältebehandlung: Nekrose, Osteogenese und Remodelling. Weiterhin führten sie
Untersuchungen zur klinischen Anwendung verschiedener kryochirurgischer Techniken in der
Behandlung von Kiefertumoren durch. Als Methode der Wahl definierten sie die Applikation
von flüssigem Stickstoff in Form eines Kältesprays.
Mit Ziel einer Optimierung der Kälteapplikation stellen Kerschbaumer et al. (1980) die
Ergebnisse einer zweiteiligen tierexperimentellen Studie vor, bei denen die Frierungen unter
anderem mittels geschlossener Experimentalsonden durchgeführt wurden. Im ersten Teil
wurden verschiedene Formen der Stickstoffapplikation miteinander verglichen, wobei die
intramedulläre Frierung mit einer leicht gebogenen, nach V-förmiger Osteotomie in den
Knochen eingebrachten Kryosonde die geringsten Nebenwirkungen zeigte. Im zweiten Teil
der Studie zeigte sich unter anderem, dass die Heilung einer Osteotomie in einem
kryochirurgisch behandelten Bereich stark verzögert ist und dass in diesem Bereich
angebrachte Plattenosteosynthesen durch Ausriss der Schrauben aus dem Knochen versagen
können. Bei zwei Tieren kam es zu einer Osteomyelitis, so dass die Autoren eine
perioperative antibiotische Abdeckung empfahlen.
Eine weitere Komplikation nach kryochirurgischer Behandlung ist das Auftreten von
Knochenmarksembolien, die de Vries (1983) erstmals beschrieb. Als Folge einer
intramedullären Druckerhöhung durch die sich ausbreitende Eisfront kann es zum Auftreten
von Knochenmarksembolien kommen. Demgegenüber steht eine hämodynamische
Untersuchung von Kerschbaumer et al. (1982), die während Kryoablation im Tierversuch
keinen Hinweis auf klinisch relevante Lungenembolien fanden.
Auch außerhalb des Gebietes der Tumorchirurgie fand die Kältetherapie Einzug in den
chirurgischen Bereich.
Marciani et al. (1986) führten Versuche an Kiefergelenken von Affen durch, um eine neue
Behandlungsmöglichkeit für schmerzhafte Kiefergelenksarthrosen zu entwickeln.
Lenz und Preussler (1975) sowie Schneider (1981) untersuchten die kryochirurgischen
Effekte am wachsenden Knochen und konnten belegen, dass Frierungen im Bereich der
Epiphysenfugen zu einem partiellen oder vollständigen Wachstumsstillstand durch
vorzeitigen Schluss der Epiphysenfugen führen. Es resultierten Varus- oder
Valgusdeformitäten der betroffenen Extremität.
Müller et al. (1985) stellten an einem Osteosarkommodell an Mäusen die kryochirurgische
Behandlung mit einer lokalen Resektion sowie der Amputation der Extremität gegenüber.
Dabei zeigten die kryochirurgisch behandelten Mäuse weniger Lokalrezidive als die
Resektionsgruppe und eine geringere Metastasierungsrate als die Amputationsgruppe. Man
folgerte daraus, dass es einen immunologischen Effekt gegenüber den Tumorzellen geben
müsste, der durch die kryochirurgische Behandlung induziert wird.
Malawer et al. (1988) untersuchten den Effekt von flüssigem Stickstoff versus
Knochenzement auf normalen Knochen sowie den Durchbau von eingebrachter Spongiosa
anhand eines simulierten Tumors in Form einer Knochenhöhle. Hierbei zeigte sich, dass
durch die Kältebehandlung eine Nekrosezone von 7-12 mm um die Höhle herum erzeugt
wurde, während um den Knochenzement keine Nekrose entstand. Die Inkorporierung der in
die Knochenhöhle eingebrachten Spongiosa war nach Stickstoffbehandlung im Vergleich zur
Kontrollgruppe ohne Frierung deutlich verzögert, was die Autoren mit einer mikrovaskulären
Thrombosierung und nachfolgender ischämischer Infarzierung erklären.
Auch Yun et al. (1993) bestätigten die Studienergebnisse von Malawer. Sie wiesen nach, dass
die Nekrosezone nach Kryobehandlung die maximale Ausdehnung mit 14 mm vom
Resektionsrand weg erreichte, gefolgt vom Knochenzement mit 2,8 mm (hitzebedingt beim
Aushärten des Zements). Ohne Erfolg hinsichtlich Ausbildung einer Nekrose blieb die
Applikation von Phenol.
Keijser et al. (1999) stellten entgegen theoretischen Erwartungen am Kaninchenmodell fest,
dass die Minderung des Blutflusses im zu operierenden Gewebe mittels eines Tourniquets
keine signifikante Vergrößerung der Nekrosezone zur Folge hatte.
Robinson et al. (2001) untersuchten an 16 humanen Knochentumoren (6 Chondrosarkome, 8
Metastasen und 2 Riesenzelltumore) die Wirkung von Frierzyklen auf die Tumorvitalität.
Verwendet wurde ein Kryosystem auf der Basis von Argongas. Nach Curettage des Tumors
und folgender kryochirurgischer Behandlung wurde an 5 unterschiedlichen Stellen die
Tumorvitalität mittels einer quantitativen histologischen Evaluation bestimmt. Bereits der
erste Frierzyklus von 5 Minuten bei -40° C ließ die Zellvitalität auf 5% des Ausgangswertes
sinken. Dieser Wert konnte durch einen zweiten Frierzyklus nochmals deutlich gesenkt
werden. Ein dritter Frierzyklus hingegen hatte keinen verringernden Effekt mehr auf die
Zellvitalität. Somit reichen 2 Frierzyklen für eine ausreichende kryoablative Wirkung aus.
Im Bezug auf die Knochenheilung nach Kryoablation untersuchten Keijser et al. (2002) 62
Ziegen. Es sollte die Auswirkung einer Spongiosaplastik auf einen schnelleren
Heilungsverlauf gezeigt werden. Bei den Ziegen wurde im Bereich der femoralen Diaphyse
eine definierte Kryoablation nach Ausbohren eines Knochenzylinders gesetzt. Der Hälfte der
Tiere wurde nach Frierung autologe Spongiosa aus dem Sternum in den Defekt eingesetzt.
Nach 0, 4, 7, 10, 13, 16 und 26 Wochen wurden die Tiere getötet und die betroffenen Femora
computertomographisch, histologisch und biomechanisch (Torsionsstabilität) aufgearbeitet.
Sowohl die Knochenneubildung als auch die Knochenstabilität waren in beiden Gruppen
gleich und die Spongiosa nach 10 Wochen resorbiert. Daraus folgerten die Autoren, dass eine
Spongiosaplastik keinen Einfluss auf den Heilungsverlauf hat.
Pogrel et al. (2002) jedoch revidierten diese These zumindest für die Kryobehandlung von
Kieferknochen. Neun Yucatan-Minischweinen wurden Läsionen am Unterkieferknochen
durch Einbringen von flüssigem Stickstoff gesetzt. Bei einem Teil der Tiere wurde
anschließend eine autologe Spongiosaplastik durchgeführt. Nach 3 Monaten zeigte sich in der
Gruppe ohne Spongiosaplastik bei der Hälfte der Tiere eine Sequesterbildung mit verzögerter
Wundheilung, während in der Gruppe mit Spongiosaplastik eine erhöhte Rate an
Knochenneubildung nachgewiesen werden konnte. Hieraus folgte die Empfehlung, dass
zumindest bei Behandlung im Kieferbereich mit einer anschließenden Spongiosaplastik
bessere Heilungserfolge erzielt werden können.
Popken et. al. (2001) untersuchten Art und Ausbildung der Eiskristalle in Schweine- und
Menschenlebern sowie in Lebermetastasen beim Menschen unter Verwendung neuartiger
Miniaturkryosonden. Durch den Vergleich zwischen der Ausbreitung der Eiskristalle einer 8-
mm-Kryosonde zur neuartigen 3-mm-Kryosonde konnte im Lebergewebe eine bessere
präoperative Planung und zielgenauere OP-Durchführung mit einer maximalen Ausbreitung
der Kristalle von 31 mm zirkulär um die Sonde bei der neuen Miniaturkryosonde und
maximaler Ausbreitung von 44 mm bei herkömmlichen Sonden gewährleistet werden.
Erstmals untersuchten Popken et. al. (2003) die Einwirkung von Miniaturkryosonden auf
Knochengewebe in vitro und in vivo. Hierbei wurde die Kühlleistung im Vergleich von einer
Sonde versus zwei Sonden optisch und thermisch zwischen Knochengewebe und einem
Referenzgel verglichen. In vivo wurde mittels Messfühlern die Kühlleistung an Femur und
Tibia des Schafes gemessen. Bei Verwendung zweier Sonden trat ein synergistischer Effekt
ein, der die Expansion der Eiskristalle förderte; jedoch traten auch bei Verwendung nur einer
Sonde im Umkreis von 1 cm Temperaturen von unter -50° C auf. Histologisch konnte der
Zelltod bis in die -10° C-Gefrierzone nachgewiesen werden.
Popken et. al. (2004) testeten neue Miniaturkryosonden am Schafmodell. Im Umkreis von 1
cm um die Sonde konnte eine Temperatur von maximal -50° C erreicht werden, bei
Verwendung zweier Sonden konnte durch synergistische Effekte die Temperatur auf -71° C
gesenkt werden.
Je mehr Frierzyklen durchgeführt wurden, desto schneller sank die Temperatur des
umliegenden Gewebes. Eine sichere Ablation des kryochirurgisch behandelten Knochens in
der Frierzone konnte histologisch bewiesen werden. Durch die Einwirkung mehrerer Sonden
konnte die Kryozone deutlich erweitert werden.
1.5.3 Klinische Anwendung
Auch in die klinische Anwendung hat die orthopädische Kryochirurgie Einzug gehalten. Sie
kommt besonders dann zur Anwendung, wenn gängige Verfahren keine Aussicht auf Erfolg
mehr bringen können oder wenn die einzige Alternative die Amputation der betroffenen
Extremität ist. Sie stellt somit eine wertvolle palliative Maßnahme dar; aber auch im
therapeutischen Bereich können gute Heilungserfolge erzielt werden.
Die erste kryochirurgische Behandlung eines Knochentumors beim Menschen wurde von
Marcove (1964) durchgeführt. Der Patient litt an einer schmerzhaften, strahlenresistenten
Knochenmetastase eines Bronchialkarzinoms. Nach Knochenfensterung und Curettage des
Tumors wurde mittels eines Stahltrichters Gelfoam in die Knochenhöhle eingebracht.
Anschließend wurde über den Trichter flüssiger Stickstoff zugeführt, der den Gelfoam frieren
ließ und dies den Knochen abdichtete. Durch die Operation konnte beim Patienten
Schmerzfreiheit erzielt und eine palliative Amputation umgangen werden. Beflügelt durch
den guten klinischen Verlauf wurden die Indikationen dieser Behandlungsmethode von
Marcove (1968, 1969) bald auch auf primär gutartige Knochentumore wie aneurysmatische
Knochenzysten und Riesenzelltumore sowie wenig maligne Chondrosarkome ausgedehnt.
Es folgten zwei weitere Studien von Marcove (1973, 1978), bei denen insgesamt 52 Patienten
kryochirurgisch behandelt wurden (hauptsächlich Riesenzelltumore). Bei klinisch und
radiologisch unauffälligem Verlauf wurden bei allen Patienten Second-Look-Biopsien
entnommen. Bei 12 von 52 Patienten konnten vitale Tumorreste nachgewiesen werden.
Ferner zeigte sich, dass kryochirurgisch bedingte Nervenläsionen reversibel waren. Marcove
et al. (1977) operierten 18 Patienten mit Chondrosarkomen in gleicher Weise. Bei 12
Patienten kam es zu Komplikationen; 6 Patienten mussten nach Rezidivbildung erneut
chirurgisch versorgt werden. Bei den anderen 6 Patienten kam es zu Spontanfrakturen.
Insgesamt mussten bei 7 der 18 Patienten ablative Maßnahmen durchgeführt werden, jedoch
blieben alle Patienten bis auf einen über einen Beobachtungszeitraum von 66 Monaten
rezidivfrei.
Marcove et al. (1977) waren es auch, die als erste die Kryochirurgie als ergänzendes
Verfahren bei der osteosynthetischen Versorgung pathologischer Frakturen bei
metastasiertem Nierenzellkarzinom einsetzten und dabei eine gute lokale Tumorkontrolle
erzielen konnten.
Oeseburg (1978) verwendete die gleiche Technik wie Marcove bei der Behandlung von 5
Patienten mit aneurysmatischen Knochenzysten. Er versuchte, den chirurgischen
Sicherheitsabstand mit Hilfe der Kältetechnik nach Curettage zu vergrößern und somit
Substanzverlust am Knochen zu vermeiden. Die Knochenhöhle wurde nach Kryobehandlung
mit Spongiosa aufgefüllt. Alle behandelten Patienten blieben über den Beobachtungszeitraum
von 35 Monaten rezidivfrei.
Eine neue Technik führten Popescu und Spirescu (1980) ein. Sie propagierten die
extrakorporale Vereisung, bei der 4 Patienten mit Unterkiefertumoren der betroffene
Mandibularanteil entfernt, dann in flüssigen Stickstoff verbracht und reimplantiert wurde. Bei
2 Patienten verlief die Revitalisierung des Knochens problemlos; die anderen 2 Patienten
erlitten in Folge schwere Infektionen im betroffenen Gebiet.
Einen weiteren Fortschritt erzielten Mirra et al. (1981), die zum ersten Mal die Kryochirurgie
in unmittelbarer Umgebung zum Rückenmark einsetzten. Bei einem Patienten mit
Riesenzelltumor des zweiten Halswirbels führten sie eine kombinierte kryochirurgische und
radiotherapeutische Behandlung ein. Zum Erstaunen der Autoren konnte der komplette
Wirbelkörper ohne Affektion des Rückenmarks gefroren werden. Man vermutete, dass die
Liquorflüssigkeit isolierende Eigenschaften aufweist. Nach 53 Monaten war der Wirbelkörper
komplett durchbaut und der Patient rezidivfrei.
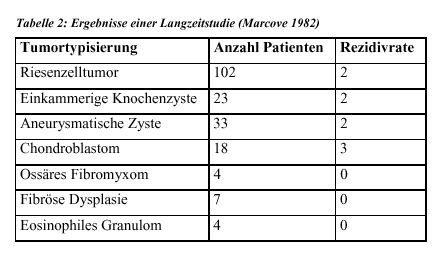
Über Ergebnisse einer Langzeitstudie bei der Behandlung verschiedener Tumortypen am
Knochen mittels Kryotherapie berichtet Marcove (1982; Tabelle 2):
Marcove (1984) war es ebenfalls, der die ersten 3 Patienten mit Osteosarkom kryochirurgisch
behandelte. Bestätigt wurde die Tumorfreiheit (Second-Look-Biopsie) bei allen 3 Patienten;
ein Patient erlitt eine unbeherrschbare Infektion, die zum Verlust der betroffenen Extremität
führte. Bei einem weiteren Patienten wurden weitere Operationen aufgrund von
Lungenmetastasen nötig. Alle Patienten blieben 38 Monate nach Behandlung tumorfrei.
Im weiteren Verlauf behandelte Marcove auch 7 Patienten mit Riesenzelltumoren des
Sakrums (Curettage und Kryochirurgie bei 4 Patienten; Teilresektion und Kryochirurgie bei 3
Patienten). Alle Patienten waren nach einer medianen Beobachtungszeit von 12,25 Jahren
erkrankungsfrei. Vier Patienten mussten wegen lokaler Rezidive erneut kryochirurgisch
behandelt werden, blieben danach aber rezidivfrei.
Nach der Entwicklung neuer Geräte wurde die Kryochirurgie auch im Bereich kleinerer
Knochen eingesetzt. Gartman und Ranawat (1984) behandelten erfolgreich ein
rezidivierendes Osteoidosteom am Fingergrundglied nach vorheriger Curettage.
Meals et al. (1989) therapierten den Riesenzelltumor eines Metakarpalknochens nach
Curettage und anschließender Spongiosaauffüllung. Eine Parästhesie durch Schädigung des
umliegenden Nervengewebes bildete sich im Zeitraum von 6 Monaten komplett zurück.
Sheth et al. (1995) konnten zeigen, dass durch die Kryoablation von Riesenzelltumoren am
distalen Radius bei erhaltener Handgelenksfunktion eine mit der Resektion vergleichbare
lokale Tumorkontrolle erreicht werden konnte.
Athanasian (1999) behandelte einen Patienten mit therapieresistenter aneurysmatischer
Knochenzyste am Fingergrundglied mittels Curettage, Kryochirurgie und
Spongiosaauffüllung. Die Knochenzyste heilte vollständig aus.
Russe et al. (1984) stellten eine alternative Methode vor, bei der mit geschlossenen
Kryosonden gearbeitet wurde. Es handelte sich dabei um gebogene, trokarartige, sowie kugel-und
halbkugelförmige Konstruktionen, die über zusätzlich angelegte Knochenfenster
außerhalb des tumortragenden Abschnitts (Trokarsonden) bzw. nach Curettage des Tumors
(Kugelsonden) in den Knochen eingebracht wurden.
Für den Bereich der Pädiatrie berichteten Malaver et al. (1991) von 25 Patienten mit benignen
Knochentumoren, die kryochirurgisch versorgt wurden. Die Lokalrezidivrate betrug 4% bei
einem funktionell guten Ergebnis von 90%. Marcove (1995) behandelte 52 pädiatrische
Patienten mit aneurysmatischen Knochenzysten mittels Curettage und Kryochirurgie, wobei
nach 85 Monaten 82% der Patienten rezidivfrei waren. Nach kryochirurgischer Behandlung
der Rezidivpatienten konnte insgesamt eine Heilungsrate von 92% erzielt werden. Schreuder
et al. (1997) behandelten 42 pädiatrische Patienten mit einfachen Knochenzysten mittels
Curettage und Vereisung; die Rezidivrate betrug nach 24,5 Monaten 5%.
Pogrel et al. (1993) erzielten eine Heilungsrate von 100% bei 37 Patienten mit
Unterkiefertumoren unterschiedlicher Genese mittels Vereisung. Die Nachbeobachtungszeit
betrug hierbei 75 Monate.
Salmassy et al. (1995) wiesen nochmals den besseren Heilungserfolg bei kryochirurgischer
Behandlung des Unterkiefers nach Curettage und Spongiosaplastik nach. Von 20 behandelten
Patienten, von denen 10 ohne Spongiosaplastik behandelt worden waren, erlitten 2 Patienten
postoperative Frakturen, wohingegen bei den Patienten mit Spongiosaplastik keine Frakturen
zu verzeichnen waren.
Schreuder et al. (1995) berichteten über das Auftreten venöser Stickstoffembolien durch
Einsprühen des Stickstoffs in 2 Fällen und erklärten dies durch intravenöse Verdampfung
inkorporierten Stickstoffs und konsekutiver Verlegung der Lungenstrombahnen durch
Stickstoffblasen. Die mutmaßlichen Embolien ließen sich bei beiden Patienten gut
beherrschen und blieben ohne Konsequenzen. Zur Vermeidung solcher Komplikationen
empfehlen die Autoren eine ausreichend weite Eröffnung der Knochenhöhle, um ein
Einfangen von sich ausdehnendem Stickstoff innerhalb der Markhöhle zu vermeiden.
Aboulafia (1994) beschrieb die Technik von Curettage, Kryochirurgie und anschließender
mechanischer Stabilisierung als Alternative zur Gelenkresektion bei ausgedehnten,
subchondral reichenden, kniegelenksnahen Tumoren. Von 9 behandelten Tumoren (6
Riesenzelltumore, 1 Chondroblastom, 1 Chondrosarkom, 1 Fibrosarkom) kam es im Verlauf
von 103 Monaten zu einem Rezidiv, das gleichermaßen nachbehandelt wurde. Bei allen
Patienten blieb die Gelenkfunktion uneingeschränkt erhalten; zwei Patienten erlitten durch die
Behandlung leichte Knorpelschäden.
Alkalay et al. (1996) behandelten bei Riesenzelltumoren mit eingetretener intraartikulärer
Fraktur zunächst die Fraktur und danach den Tumor kryochirurgisch.
Schreuder (1997) verwendete erstmals Temperaturmessfühler zur besseren Kontrolle des
Friervorgangs. Es konnte gezeigt werden, dass durch ein Stickstoffspray innerhalb von 10,7
sec an der Knochenoberfläche eine Temperatur von -50° C erreichbar war.
Schreuder (1998) veröffentlichte eine Studie von 22 Patienten mit Enchondromen und niedrig
malignen Chondrosarkomen, die nach Kryoablation 26 Monate später alle rezidivfrei waren.
Malawer et al. (1998) berichten in einer Langzeitstudie von 102 Patienten mit einem
durchschnittlichen Follow-Up von 6,5 Jahren nach kryochirurgischer Behandlung von
Riesenzelltumoren. Bei einer Rezidivrate von 15,9% konnten nach Weiterbehandlung 100
von 102 Patienten geheilt werden.
Sampson und Pogrel (1999) publizierten eine Studie mit 20 Patienten mit intraossären
Ameloblastomen im Bereich des Unterkiefers, von denen 11 mit Curettage und 9 mit
Curettage und Kryoablation behandelt wurden. Während alle 11 Patienten ohne Kryoablation
ein Rezidiv erlitten, waren alle 9 Patienten mit Kryoablation rezidivfrei..
Pogrel (2001) publizierte eine Studie von 26 Patienten mit odontogenetischen Keratozysten,
die alle mittels Curettage und Kryochirurgie behandelt wurden. Von diesen Patienten mit
Rezidiven waren bereits 22 mittels Curettage vorbehandelt worden. Von den 26 Patienten
waren nach 3,5 Jahren 23 Patienten ohne Rezidiv, 3 Patienten erlitten im Median von 1,6
Jahren ein Lokalrezidiv.
Keijser et al. (2001) untersuchten im gleichen Jahr das funktionelle Ergebnis eines Kollektivs
von 20 Patienten mit insgesamt 32 Manifestationen von fibröser Dysplasie anhand
verschiedener Scores nach, die mit Curettage, Kryochirurgie und Knochenspongiosa
behandelt worden waren. Der mediane Nachbeobachtungszeitraum betrug 6 Jahre. Es zeigte
sich, dass sowohl die Patienten mit monoostotischem als auch polyostotischem Befall ein
gutes funktionelles Outcome aufwiesen, während alle Patienten mit McCune-Albright-Syndrom
ein schlechtes funktionelles Ergebnis zeigten.
Wittig et al. (2001) berichteten über 3 Patienten mit Riesenzelltumor im Bereich des Hand-skeletts,
die kryochirurgisch behandelt wurden. Alle Patienten blieben über einen Zeitraum
von 3 Jahren rezidivfrei. Bis auf eine leichte Wundinfektion heilten alle Läsionen per primam
ab.
Boons et al. (2002) veröffentlichten eine Studie von 36 Patienten mit Riesenzelltumor, die
unterschiedlich behandelt wurden. Gruppe 1 wurde radikal operiert und der Tumor
großflächig reseziert. In Gruppe 2 wurde eine schonendere Resektion gewählt mit
anschließender Kryobehandlung. Zwar waren alle Patienten aus Gruppe 1 nach 7 Jahren
rezidivfrei, waren aber im Vergleich zur Gruppe 2 mit einer niedrigen Rezidivrate wesentlich
schlechter im Bereich der Funktionalität.
1.6 Einführung in die Kryochirurgie
1.6.1 Physikalische Vorgänge bei der Kryochirurgie
1.6.1.1 Friereigenschaften von reinem Wasser
Wasser ist der Hauptbestandteil vitaler Gewebe und dient im Wesentlichen als Lösungsmittel
für eine Vielzahl von Substanzen, die wiederum für die Zellvitalität und -integrität
unverzichtbar sind. Wenngleich reines Wasser im Vergleich zur Zellflüssigkeit andere
physikalische Eigenschaften aufweist, so ist die Kenntnis des Frierverhaltens von reinem
Wasser Grundvoraussetzung für das Verständnis der Auswirkungen von Abkühlung, Frierung
und Tauen auf lebende Zellen. Daher sollen zunächst die physikalischen Vorgänge bei der
Frierung von Wasser näher beleuchtet und diese anschließend den Abläufen bei der Frierung
von Zellflüssigkeit und Gewebe gegenübergestellt werden.
Wasser existiert in drei Phasen: gasförmig, flüssig und fest (kristallin). Jede Phase ist durch
eine bestimmte Temperatur und einen bestimmten Druck determiniert. Unter dem
Dampfdruck versteht man den Druck, bei welchem bei einer gegebenen Temperatur die
Dampfphase mit der jeweiligen festen, respektive flüssigen Phase im Gleichgewicht steht.
Jede Veränderung des Drucks führt zu einer Verschiebung des Gefrier- und Siedepunktes.
Erhöht sich der Druck, so ist die Möglichkeit der Wassermoleküle zur Verdampfung
reduziert, so dass erst über eine Energiezuführung in Form einer Temperaturerhöhung
dennoch ein Verdampfen möglich ist. Einen weiteren wichtigen Aspekt repräsentiert die
thermale Leitfähigkeit, da die Wärme/Kälte sich durch flüssige und gefrorene Anteile
während des Frier- bzw. Tauvorganges bewegen muss. Die thermale Leitfähigkeit von Eis
verändert sich mit der Temperatur und ist größer als die von flüssigem Wasser, welches als
thermaler Isolator fungiert (Franks, 1982).
1.6.1.2 Der Gefrierpunkt
Obwohl 0° C im Allgemeinen als Gefrierpunkt von reinem Wasser bei atmosphärischem
Druck bezeichnet wird, erfolgt die Initialisierung der Eisbildung erst bei Temperaturen
unterhalb von 0° C. Bei genau 0° C kommen Eiskristalle und flüssiges Wasser nebeneinander
vor und befinden sich im „Gleichgewicht“, so dass man auch vom sogenannten
„äquilibrierten Gefrierpunkt“ spricht. Damit es zum Übergang von Wasser in den festen
Aggregatzustand kommen kann, muss das System auf Temperaturen unterhalb des
„äquilibrierten Gefrierpunktes“ abgekühlt werden. Mit Beginn der Kristallisation von reinem
Wasser erhöht sich die Temperatur des Gemisches aus flüssiger und fester Phase auf 0° C und
die Temperatur verbleibt auf diesem Niveau, bis der flüssige Wasseranteil vollständig zu Eis
konvertiert ist. Ein weiterer Abzug von Wärme resultiert in einem Absinken der
Eistemperatur. Die Temperaturdifferenz zwischen 0° C und der Temperatur, an dem die
Kristallisation des Systems begonnen hat, bezeichnet das Ausmaß des „Supercooling“, d. h.
das Vorliegen von flüssigem Wasser unterhalb des Gefrierpunktes. In reinem Wasser liegt das
Limit für ein Supercooling bei -39° C, da es erst bei dieser Temperatur zu einer einheitlichen
Kristallisation kommt (Franks, 1982).
1.6.1.3 Die Kristallisation
Die Kristallisation bedingt eine Erniedrigung der Temperatur, die als Kühl- oder als Frierrate
angegeben werden kann. Die Kühlrate bezeichnet die Temperaturveränderung pro Zeiteinheit
(°T x min -1 ), während die Frierrate die Menge der Eisbildung pro Zeiteinheit (g x min -1 )
beschreibt. Die Frierrate kann sowohl mikroskopisch als auch kalorimetrisch ermittelt
werden.
Für kryobiologische Fragestellungen ist es wichtig, die Nukleation von Eiskristallen
(Kristallisation) kontrollieren zu können. Die Kristallisation einer flüssigen Phase erfordert
die Anwesenheit von Kristallisationskernen, an welchen sich die feste Phase ausbildet. Bei
reinem Wasser stellen Cluster von Wassermolekülen, die über H-Bindungen verknüpft sind,
solche Kerne dar. Diesen Vorgang bezeichnet man als homogene Kristallisation. Zur Bildung
eines Kristallisationskernes bedarf es einer bestimmten Kühlrate (Temperaturveränderung pro
Zeiteinheit), deren Stärke zur Ausbildung verschieden großer Radien der Eiskristalle führt.
Langsame Kühlraten, d. h. eine langsame Reduktion der Temperatur (weniger als 1° C/min),
induzieren die Bildung großer Eiskristalle um einige Kristallisationskerne. Hohe Kühlraten
hingegen führen zur Bildung vieler kleiner Kristalle, die jedoch thermodynamisch instabil
sind und zur Fusion tendieren, um über eine Oberflächenverringerung einen günstigeren
energetischen Zustand zu erreichen. Bei ausgesprochen hohen Kühlraten kommt es zu einer
Vitrifikation, der Bildung einer amorphen, transparenten, glasähnlichen Eisstruktur, da
hierdurch rasch eine Temperatur erreicht wird, die thermodynamisch eine Umwandlung von
Wassermolekülen in Kristalle verhindert (Angell, 1982; Cosman, 1989; Franks, 1982;
Uhlmann, 1972).
1.6.1.4 Friereigenschaften von Lösungen
Die Lösung von Stoffen, z. B. von Elektrolyten, führt zu einer deutlichen Veränderung der
thermischen Eigenschaften der Lösung. Das chemische Potential reiner Flüssigkeiten ist
größer als das Potential von Lösungen. Da lebendes Gewebe primär aus Lösungen besteht, ist
diese Tatsache aus kryobiologischer Sicht von großer Bedeutung.
Durch gelöste Stoffe wird der „äquilibrierte Frierpunkt“ einer Lösung reduziert. Werden, wie
in biologischen Systemen, verschiedene Flüssigkeiten gemischt, so ergibt sich der
Dampfdruck des Gemisches entsprechend dem Gesetz von Raoult. Dieses beschreibt den
Dampfdruck des Gemisches als Funktion der Dampfdrücke der einzelnen Komponenten und
ihrer molaren Fraktionen:
Ptot = PAXA + PBXB
PA und PB entsprechen dem jeweiligen Dampfdruck der Komponenten A und B, XA und XB
der jeweiligen molaren Fraktion.
Die gelösten Stoffe vermindern das chemische Potential und den Dampfdruck einer Lösung,
indem ihre Moleküle mit den Molekülen des Lösungsmittels im Bereich der
Phasentransformation miteinander konkurrieren. Hierdurch wird die Möglichkeit zur
Verdampfung des Lösungsmittels reduziert.
Im Rahmen des Friervorganges wird die Kristallisation behindert, da die gelösten Substanzen
dem Lösungsmittel den Zugang zu den Kristallisationskernen blockieren. Daraus resultiert
eine Erniedrigung des Dampfdruckes, welches sich in einer Verminderung des „äquilibrierten
Gefrierpunktes“ zeigt (Abbildung 1).

Mit Abnahme der Temperatur von Wasser sinkt auch sein Dampfdruck. Am „äquilibrierten
Gefrierpunkt“ von Wasser (T0) kommt es zur Eisbildung und die Dampfdruckkurve entspricht
der von Eis (AB). Der Dampfdruck der Lösung ist niedriger als der des Lösungsmittels
(Wasser) und vermindert sich ebenfalls mit Abnahme der Temperatur. Die Dampfdruckkurve
der Lösung schneidet die Dampfdruckkurve von Eis (TS). An diesem Punkt beginnt die
Phasentransformation der Lösung (flüssig fest). Die gelösten Substanzen haben also den
Gefrierpunkt um T0 minus TS oder ∆T reduziert. Für verdünnte wässrige Lösungen, d. h. bei
einer Konzentration gelöster Stoffe von weniger als 0,01 M, ist die molare
Gefrierpunktkonstante (Kf) gleich 1,86 – somit ist
∆T = Kf m,
wobei die Variable „m“ hierbei die Molalität (mol/kg) der Lösung repräsentiert. Dieses
Verhältnis gilt jedoch nur für stark verdünnte Lösungen. Diesbezüglich verhalten sich 0,01
Mol NaCl gelöst in 1 kg Wasser wie eine 0,02 molare Nicht-Elektrolyt-Lösung mit einer
Erniedrigung des Gefrierpunktes um 0,037° C.
Eine Erniedrigung des Gefrierpunktes bedeutet, dass „Supercooling“ vor der Nukleation
stattfindet, wobei jedoch die Temperatur der Lösung nach der Nukleation auf Werte unterhalb
des Gefrierpunktes von Wasser zurückspringen wird. Jedoch kommt es hierbei nicht zur
Ausbildung eines Plateaus wie bei reinem Wasser. Vielmehr verzeichnet man einen
zunehmenden Temperaturabfall (Abbildung 2 -Abbildung 3). Dies begründet sich in der
Tatsache, dass durch die Eisbildung freies Wasser aus der Lösung abgezogen wird und sich
somit eine konsekutive Konzentrationserhöhung ergibt (Fahy, 1980, Franks, 1982, Pegg,
1986; Taylor, 1981).


1.6.2 Grundlagen der Kryochirurgie (Gage, 1998; Baust, 1998)
Im Folgenden sollen die Mechanismen der Gewebsschädigung durch kryochirurgische
Eingriffe erläutert werden. Die Hauptaspekte der kryochirurgischen Technik beruhen auf drei
wesentlichen Punkten: Schnelles Frieren, langsames Tauen und der Wiederholung des Frier-Tau-
Zyklus. Die Auswirkungen diese Verfahrens kann in zwei Gruppen eingeteilt werden:
eine unmittelbare und eine verzögerte Reaktion .
1.6.2.1 Unmittelbare Zellschädigung
Mit dem Temperaturabfall im Gewebe kommt es zur Stagnation des Zellmetabolismus. Bei
ausreichender Temperatur und Dauer kann es allein durch hypotherme Verhältnisse im
Bereich des Nullpunktes in der Zelle zum Zelltod kommen.
Fällt die Temperatur in den Bereich unter 0° C, kristallisiert Wasser. Zuerst kommt es zur
Ausbildung von Eis im Extrazellulärraum. Der Entzug von Wasser, d. h. die Verbringung von
Wasser aus dem flüssigen in den festen Zustand, führt zu einer hyperosmotischen Umgebung
im Extrazellulärraum, die dazu führt, dass Wasser aus der Zelle in den Extrazellulärraum
übertritt. Der Prozess schreitet fort durch Ausbildung von Eiskristallen, Zellschrumpfung und
Schädigung der Zellmembranen. Nach einiger Zeit wird die Zelle durch einen steigenden
Elektrolytüberschuss zerstört.
Die Dehydratation der Zelle geht nicht immer mit Zelltod einher. Eine wesentlich sicherere
Methode, den Zelltod herbeizuführen, besteht in der Methode, intrazellulär Eiskristalle zu
erzeugen. Die Ausbildung solcher Kristallformationen wird nur bei sehr hohen
Kühltemperaturen erreicht. Ab Temperaturen unter -40° C bilden sich intrazellulär Kristalle
aus. Diese Kristalle sind in der Lage, Zellorganelle und Membranen zu zerstören und den
sicheren Zelltod auszulösen.
Aber nicht nur dem Frierzyklus kommt eine entscheidende Bedeutung durch den Entzug von
Wasser zu, sondern auch der Tauzyklus spielt eine wichtige Rolle bei der Zellschädigung.
Nach Frieren des Gewebes auf unter -40° C und anschließendem Tauen beginnen sich
abermals große Kristalle zu bilden. Besonders im Temperaturbereich von -20° C bis -25° C
tritt eine solche Rekristallisation auf.
Taut man das Gewebe weiter auf, tritt Wasser aus dem Extrazellulärraum durch die
geschädigten Zellmembranen in den Intrazellulärraum über und schädigt durch den
intrazellulären Druckanstieg weitere Membranen.
1.6.2.2 Verzögerte Zellschädigung
Als verzögerte Reaktion werden diejenigen Prozesse gesehen, die nicht unmittelbar mit der
direkten, mechanischen Zerstörung des Gewebes einhergehen. Zu diesen Reaktionen gehören
in erster Linie der Verlust der Mikrozirkulation der Zelle und die damit verbundene Anoxie.
Ein Gewebe reagiert auf Kühlung mit einer Vasokonstriktion und einem damit verbundenen
nachlassenden Blutfluss. Durch das Frieren kommt der Blutfluss zum Stillstand. Beim Tauen
setzt die Zirkulation wieder ein, jetzt aber verbunden mit einer Vasodilatation. Durch die
entstehende Hyperämie und die dadurch hervorgerufene Permeabilität der Gefäßwände
entsteht innerhalb von Minuten ein Ödem, das mehrere Stunden anhält.
Die erhöhte Permeabilität der Gefäßwände kommt durch Schädigung der Endothelzellen
durch den Frierzyklus zustande. In folge der Schädigung kommt es nicht nur zu Ödemen,
sondern auch zur Thrombozytenaggregation und Ausbildung von Mikrothromben, die die
Mikrozirkulation innerhalb von 30-45 Minuten zum Erliegen bringen.
Die meisten Kapillaren sind 4 Stunden nach Tauen komplett durch Mikrothromben verlegt;
größere Arteriolen meist erst nach 24 Stunden. Durch diese irreversible Verhinderung der
Zirkulation kommt es in Folge zur Nekrose des betroffenen Gewebes.
1.6.3 Die kryochirurgische Technik
1.6.3.1 Die Frierrate
Die Zeit, die man benötigt, um das Gewebe auf die gewünschte Temperatur zu bringen, ist so
kurz wie möglich zu wählen, um die höchstmögliche intrazelluläre Eisproduktion zu
gewährleisten.
Eine hohe Frierrate erreicht man nur in direkter Umgebung der Kryosonde. Das umliegende
Gewebe weist einen wesentlich höheren Zeitindex bis zur vollständigen Frierung auf.
Dementsprechend erscheinen intrazelluläre Eisformationen bevorzugt in direkter Umgebung
der Kryosonde, wohingegen in der Peripherie extrazelluläre Eisformationen und geschrumpfte
Zellen überwiegen.
Die Frierrate gilt jedoch nicht als das entscheidende Kriterium für die Herbeiführung des
Zelltodes, sondern vielmehr wird die Frier-Tau-Rate wird als das entscheidende Kriterium
angesehen.
1.6.3.2 Die Gewebetemperatur
Um ein Gewebe sicher abzutöten, muss die Temperatur so gewählt werden, dass bei allen
betroffenen Zellen Zelltod eintritt. Die benötigte Temperatur hängt entscheidend vom Gewebe
ab, welches man kryooperativ behandeln möchte. Obwohl der Zelltod aus sehr vielfältigen
Gründen eintreten kann, kommt der Gewebetemperatur die entscheidende Bedeutung zu. Die
Wahrscheinlichkeit des Zelltods nimmt mit abnehmender Gewebetemperatur zu.
Übereinstimmend ist die Meinung diverser Kryochirurgen, dass ein sicherer Zelltod ab einer
Temperatur von unter -50° C bis -60° C zu erreichen ist.
1.6.3.3 Die Frierzeit
Die Frierzeit ist nicht entscheidend für den Erfolg der Knochenkryochirurgie. Sobald man das
Gewebe auf unter -60° C kühlt, spielt die einwirkende Zeit keine Rolle mehr. Sie ist lediglich
entscheidend für Temperaturen oberhalb -30° C, bei denen die komplette Kristallisation von
Wasser nicht stattfindet. Im Zuge von Rekristallisation kann eine verlängerte Frierzeit eine
größere Gewebszerstörung herbeiführen. In der Kryochirurgie an Knochengewebe jedoch ist
die Frierzeit unerheblich.
1.6.3.4 Die Taurate
Ein langsames Tauen wird als Hauptaspekt der Zellzerstörung angesehen. Rasches Auftauen
erhöht die Wahrscheinlichkeit, dass Zellen überleben können. Entscheidende Bedeutung
kommt hierbei der Bildung großer Eiskristalle zu, die sich bei langsamer Taurate viel stärker
ausbreiten können. Die Eiskristalle sind für die mechanische Zerstörung der Zellen
verantwortlich. Die Ausbildung der Kristalle ist am größten im Temperaturbereich zwischen
0° C und -40° C, besonders bei -20° C bis -25° C.
In Experimenten zeigte sich, dass langsames Tauen einen viel größeren Effekt auf die
Zellzerstörung hat als schnelles Frieren.
1.6.3.5 Die Wiederholung des Frier-Tau-Zyklus
Dem Frier-Tau-Zyklus kommt entscheidende Bedeutung zu, da Zellen, die wiederholt
physikochemischen Temperatureffekten ausgesetzt sind, stärker geschädigt werden. Mit
jedem Frier-Tau-Zyklus wird die gewünschte Temperatur im Gewebe schneller erreicht, die
Ausbreitung der Frierung im Gewebe wird von Mal zu Mal größer und der Randbezirk der
Gewebszerstörung wird bei jedem Zyklus weiter in die Peripherie verschoben. Der Grund für
die Ausbreitung der Läsion ist, dass Gewebe, das bereits im ersten Zyklus effektiv zerstört
wurde, einen wesentlich geringeren Widerstand darstellt als im zweiten Zyklus.
Bei Temperaturen unter -50° C, bei denen unweigerlich Zelltod eintritt, spielt also die
Wiederholung des Zyklus insofern eine Rolle, als ein größeres Gebiet erreicht werden kann
(Tab. 3- 4).

1.6.4 Funktionsweise von Kryogeräten
1.6.4.1 Kühlmittel
Aufgrund ihrer thermodynamischen Eigenschaften werden Kühlflüssigkeiten in 2 Kategorien
unterteilt:
- Flüssigkeiten mit einem Siedepunkt unter -150° C (Stickstoff, Sauerstoff)
- Flüssigkeiten mit einem Frierpunkt über -150° C (Kohlendioxid, Freon)
Das am häufigsten angewandte Kühlmittel ist flüssiger Stickstoff. Flüssigstickstoff ist farb-und
geruchlos, nicht brennbar, sehr reaktionsträge, hat einen Siedepunkt von -196° C und
einen Frierpunkt von -204° C. Im Periodensystem der Elemente steht es unter den
Nichtmetallen der 5. Hauptgruppe mit einer Massenzahl von 14,0067.
1.6.4.2 Möglichkeiten der Kälteerzeugung
- Phasenänderung: am effektivsten, da sehr tiefe Temperaturen erreicht werden können.
Der flüssige Stickstoff wird durch ein dünnes Rohr zur Sondenspitze transportiert.
Dabei wird Wärme absorbiert und der Stickstoff verdampft. Das Gas fließt dann durch
ein Außenrohr wieder ab. Zu- und abführender Schlauch sind vakuumisoliert.
Temperaturregulierung erfolgt durch Veränderung des Stickstoff-Flows. Mögliche
Minimaltemperatur: -196° C
- Joule-Thompson- Effekt: Wenn Gase (z. B. Kohlendioxid) unter Druck durch eine
Düse geleitet werden, entsteht infolge der plötzlichen Gasexpansion ein
Temperaturabfall. Mögliche Minimaltemperatur: -90° C
- Peltier-Effekt (thermoelektrische Abkühlung): Halbleiter aus Wismuththellurid
erzeugen einen Temperaturgradienten unter elektrischer Spannung.
- Adiabatische Gasexpansion mittels Turboexpander: System der Zukunft.
Gasexpansion durch Turbinen mit Helium als Kühlmittel. Mögliche
Minimaltemperatur: unter minus 196° C; zur Zeit nur industriell genutzt.
1.6.4.3 Temperaturregistrierung
Die Temperaturregistrierung erfolgt mittels Thermoelementen aus Kupfer-Konstantan oder
Eisen-Konstantan, die auf der Basis von Spannungsdifferenzen, welche an der
Verbindungsstelle zweier Drähte (Kupfer und Konstantan) bei einer Temperaturdifferenz
entstehen ( Seebeck-Effekt), eine Messung der Temperatur ermöglichen. Referenzlösung ist
Eiswasser. Registrierung erfolgt über Potentiometerschreiber oder Voltmeter.
1.7 Aufbau moderner Kryotherapiegeräte
1.7.1 Basiseinheit
Handelsübliche Kryogeräte arbeiten heute fast alle mit flüssigem Stickstoff als Kühlmittel.
Die angebotenen Geräte und deren Funktionsweise richten sich nach der medizinischen
Anwendung. So reichen häufig im Bereich der Dermatologie vergleichsweise günstige Geräte
aus, die die Kryosonden durch das Prinzip der Schwerkraft versorgen, indem der Dewar-Behälter
höher als die Sondenspitze platziert wird. Bei diesem Verfahren wird nur ein
geringer Überdruck aufgebaut und tiefe Temperaturen sehr zeitverzögert erzielt.
Im Bereich der Tumorchirurgie werden Kryogeräte eingesetzt, die im Dewar-Behälter einen
Druckgradienten aufbauen, der die Sonden aktiv mit Stickstoff versorgt. Der Druckaufbau
erfolgt entweder mittels Wärmezufuhr, der den Stickstoff verdampfen lässt oder durch
Druckaufbau von außen mittels Zufuhr eines Gases in den Dewar.
Bei beiden Prinzipen besteht der Nachteil darin, dass eine große Menge Stickstoff pro
Zeiteinheit „verbraucht“ wird, der dann entweder aus dem System ausgeleitet wird oder in
einem zweiten Dewar-Gefäss aufgefangen werden muss. Bei den Kryogeräten der neuen
Generation wird mittlerweile der Stickstoff in den gleichen Dewar zurückgeführt.
1.7.2 Aufbau der Kryosonden
Man unterscheidet drei Arten von Kryosonden: elektrische, Hochdrucksonden und Sonden
mit Stickstoffkühlung.
Elektrische Kryosonden nutzen den Peltier-Effekt, bei dem zwischen zwei Halbleitern aus
Wismuththellurit bei Anlegung einer elektrischen Spannung eine Temperaturdifferenz
resultiert. Die Kühlleistung solcher Sonden erreicht maximal -60° C und wird aus diesem
Grund fast ausschließlich in der Dermatologie angewendet (Hewitt, 1997). In der
Veterinärmedizin können diese Geräte zum Beispiel bei einer Kryoepilation bei Distichiasis
eingesetzt werden.
Bei den Hochdruckkryosonden macht man sich den Joule-Thompson-Effekt zu Nutze, bei
dem ein hoch komprimiertes Gas mittels einer Düse in die Sonde geführt wird. Durch die
Volumenexpansion des Gases in der Sondenspitze wird Energie in Form von Wärme
verbraucht und die Umgebungstemperatur sinkt. Die Kühlleistung ist dabei abhängig von Art
und Druck des verwendeten Gases. Verwendet werden häufig Argon, Freon oder
Kohlendioxid. Vorteil dieser Technik ist der konstruktionsbedingt kleinere Durchmesser der
Sonden im Gegensatz zu Kryosonden. Als Nachteil ist erneut die erreichbare
Minimaltemperatur anzusehen (ebenfalls maximal -60° C).
Stickstoffgekühlte Kryosonden entziehen der Umgebung Wärme durch Überschreitung des
Siedepunkts des flüssigen Stickstoffs. Ein großer Vorteil hierbei ist die erreichbare
Kühltemperatur von bis zu -196° C. Durch neue Techniken wurde Supercooling möglich, bei
dem in einem Vakuum Stickstoff unter Druck durch einen Wärmetauscher geleitet wird.
Hierbei werden Temperaturen von bis zu -209° C möglich (Baust, 1997).
1.7.3 Aufbau des Erbe-Cryo 6
Das bei den Operationen verwendete Gerät ist ein handelsübliches Kryochirurgiegerät der
Firma Erbe™, Tübingen (Abbildung 4).

Das „Erbokryo CS-6“- System (Erbe, Tübingen) ist ein kommerziell erhältliches
Kryotherapiegerät, bestehend aus einem Gehäuse mit Steuereinheit, sowie vakuumisolierten,
flexiblen Schläuchen, an deren Enden die Kühlsonden angebracht sind. Der Durchmesser
einer Sonde beträgt 3,2 mm. Im Gehäuse befindet sich ein 47 Liter fassender, ebenfalls
vakuumisolierter Tank („Supply Dewar“) mit flüssigem Stickstoff, welcher mittels einer
erstmals eingesetzten Tauchpumpe den flüssigen Stickstoff in die Sonden pumpt. Durch
dieses Verfahren wird ein Betriebsdruck des Systems von bis zu 15 bar möglich, das die
Stickstoffzirkulation durch die angeschlossenen Sonden in Gang setzt. Der Stickstoff erreicht
die 3 cm lange Gefrierzone an der Sondenspitze („Freezing Zone“) in flüssiger Form (-196°
C) durch eine zentrale Zufuhrleitung und verdampft unter Wärmeabsorption. Mittels einer
strömungsoptimierten Wärmetauschung werden unerwünschte Siedeeffekte des Stickstoffs
minimiert und so die Kälte extrem schnell und unter hohem Wirkungsgrad an das umliegende
Gewebe abgegeben. Die Stickstoffflussrate kann dabei für jede Sonde in vier Stufen zwischen
25 und 100% der Maximalrate (1,5 l/min) gewählt werden. Das Stickstoffgas fließt
anschließend durch ein koaxiales Außenrohr wieder in den Tank ab. Insgesamt können 6
Kryosonden simultan verwendet werden.
Das Monitoring der Kryoläsion erfolgt mittels Temperaturmeßfühler, die im Therapiefeld
platziert werden. Bei dem verwendeten Gerät handelt es sich um Temperaturfühler aus
Nickel/Nickelchrom (Abbildung 5- 8).



1.8 Stabilitätsprüfungen
Es gibt nur sehr wenige Veröffentlichungen über Stabilitätsprüfungen an Schafsknochen.
Nafei et al.(2000) publizierten eine Studie an 30 ausgewachsenen Schafen sowie 20
Jungtieren, um das Verhältnis zwischen Alter und mechanischen Eigenschaften am Knochen
zu untersuchen. Als Testmaterial dienten Knochenwürfel, die aus dem zu testenden Gebiet
ausgestanzt worden waren. Es erfolgte eine Testung auf unterschiedliche biomechanische
Belastungen wie Spannung, Elastizität, Energieabsorption bis zum Eintreten der Fraktur und
relativer Energieverlust. Die Analyse erfolgte durch eine universelle
Materialprüfungsmaschine mittels extensometrischer Messung.
Baumgaertel et al. (1994) veröffentlichten eine Studie über vergleichende osteosynthetische
Versorgungstechniken bei Mehrfragmentfrakturen an 36 Schaf-Femora. Bei der
biomechanischen Testung wurden die Schaf-Femora nach partieller Einbettung in Acrylat
einer exzentrisch axialen Last bis zum Bruch unterzogen. Als Prüfgerät diente das Instron-Gerät.
2 Tiere, Materialien und Methoden
2.1 Versuchsaufbau und Durchführung
Zur Untersuchung kamen 32 erwachsene Schafe weiblichen Geschlechts der Rassen Merino-Landschaf
und Texel mit Körpergewichten zwischen 39 und 76 kg. Die Tiere wurden mittels
Halsbändern identifiziert. Eine Woche vor Operationsbeginn wurden die Tiere aufgestallt,
hatten freien Zugang zu Wasser und Heu und erhielten zweimal täglich zusätzlich Kraftfutter.
12 Stunden vor OP wurde das Futter entzogen.
Es erfolgte eine Einteilung in 4 Gruppen zu je 8 Tieren:
Gruppe 1: 6-Monats-Gruppe (Überlebenszeit post OP 6 Monate)
Gruppe 2: 4-Monats-Gruppe (Überlebenszeit post OP 4 Monate)
Gruppe 3: 2-Monats-Gruppe (Überlebenszeit post OP 2 Monate)
Gruppe 4: „Akutschafe“ (Überlebenszeit post OP 1 Woche zum Nachweis der Apoptose)
Alle Schafe wurden unmittelbar vor der Operation gewogen.
Als Versuchsknochen wurden das rechte Femur und die linke Tibia definiert; Kontrolle war
der jeweils gegenüberliegende Knochen. Die Wahl fiel auf das rechte Femur, weil die Schafe
zwangsweise in linker Seitenlage fixiert werden mussten, da ansonsten die Aorta durch das
Gewicht des Pansens komprimiert würde. Zur Bohrung der Kontrolle am linken Femur
wurden die Tiere nur kurzfristig in die rechte Seitenlage verbracht.
Alle Femora und Tibiae wurden mittels Knochenmarkern markiert und gelangten im weiteren
Verlauf zur magnetresonanztomographischen, biomechanischen, röntgenologischen und
histologischen Auswertung.
Alle Operationen wurden in einem Operationssaal des Instituts für Experimentelle Medizin
der Universität Köln unter gleichen Bedingungen durchgeführt.
Als Prämedikation wurde Propofol (Disoprivan ® , Fresenius) in einer Dosierung von 12 mg/kg
intravenös verabreicht.
Alle Tiere wurden anschließend intubiert und beatmet. Als weiterführende Narkose wurde
eine Inhalationsnarkose mit Isofluran verwendet. Überwachung erfolgte mittels
Pulsoxymetrie, Kapnographie und Blutgasanalysen.
Als großlumigen Zugang erhielten die Tiere einen Zentralvenenkatheter, über den im
Bedarfsfall Glucose und isotone Kochsalzlösung verabreicht wurde. Zusätzlich wurde bei
einigen Tieren ein Swann-Gantz-Katheter via ZVK gelegt.
Präoperativ wurde eine Antibiose mit einem Breitspektrumantibiotikum (Tardomyocel
comp. ® , Bayer) in einer Dosierung von 1 ml/10 kg KG vorgenommen und 5 Tage aufrecht
erhalten. Als Antiphlogistika wurden Carprofen (Rimadyl ® , Pfizer) in einer Dosierung von 4
mg/kg KG für 5 Tage und Temgesic ® 1 Ampulle/Tier post OP eingesetzt.
Je nach postoperativem Zustand wurden die Schafe am 7.-10. Tag post OP entlassen und
erhielten Weidegang.
Eine Kontrolle der Tiere auf ihren Gesundheitszustand erfolgte in regelmäßigen Abständen
auf dem Hof des betreuenden Landwirts.
2.2 Operationsdurchführung
2.2.1 Femur
Nach Rasur des lateralen Oberschenkel- und Kniebereichs und dessen Desinfektion begann
der Hautschnitt im oberen Drittel des Femurschafts in gerader Führung bis auf den Condylus
lateralis femoris. Subkutanes Fettgewebe und oberflächliche Faszie wurden im Verlauf des
Hautschnittes durchtrennt.
Nach Retraktion der Hautränder wurde die Fascia lata durchtrennt und im kaudolateralen
Bereich zwischen Musculus vastus lateralis und Musculus glutaeobiceps stumpf präpariert.
Im der darunter liegenden Ebene wurde mittels Hohmann-Hebeln der Musculus vastus
lateralis nach kranial, der Musculus adductor nach kaudal verlagert.
Nach Ligatur der Arteria und Vena caudalis femoris distalis wurde im Bereich 3 cm über dem
kaudalen Bereich des Condylus lateralis femoris im Bereich der Fovea poplitea monokortikal
ein Bohrloch mit 4 mm Durchmesser gebohrt. Nach Vermessung der Bohrlochtiefe wurde die
Kryosonde im Bohrloch so platziert, dass das Ende auf der Gegenkortikalis auflag.
Nach Einbringen von Temperatursonden im umliegenden Weichteil- und Knochengewebe
und nach großzügiger Befreiung von Muskelanteilen am Knochen mittels Rasparatorium
wurden 2 Frierzyklen gestartet.
Frierzyklus: 9-minütiges Frieren mit anschließendem aktivem Tauvorgang; danach erneutes
9-minütiges Frieren mit anschließendem passivem Tauvorgang. Beim aktiven Tauvorgang
wird die Sonde nach Frierung auf Raumtemperatur erwärmt, wogegen beim passiven Tauen
die Sonde durch die Umgebungstemperatur passiv erwärmt wird.
Nach beiden Zyklen wird das kryochirurgisch behandelte Gewebe mittels isotoner
Kochsalzlösung gespült.
Es wurde lediglich eine fortlaufende Naht der Fascia lata mit 2/0 PDS-Faden gelegt und
anschließend eine subkutane fortlaufende Naht mit Vicryl 2/0. Hautnaht erfolgte mit
Einzelheften mit 2/0 Seidenfaden.
2.2.2 Tibia
Um die mediale linke Tibia zu erreichen, wurde die rechte Hintergliedmaße in linker
Seitenlage abduziert und fixiert.
Nach Rasur und Desinfektion des medialen Kniebereichs wurde der Gelenkspalt mit einer
sterilen Kanüle gekennzeichnet. Etwa 2 cm unterhalb des Gelenkspalts wurde ein 1,5-2 cm
langer Schnitt geführt, der bis unmittelbar auf den Knochen reichte. Nach Bohren des
ebenfalls monokortikalen Bohrloches mit Durchmesser 4 cm unter Verwendung der
Gewebeschutzhülse und Vermessung der Bohrtiefe wurde die Kryosonde bis zur
Gegenkortikalis vorgeschoben.
Es erfolgten ebenfalls 2 Frierzyklen, vergleichbar mit denen des Femur, mit Ausnahme der
Frierzeit. Bei der Tibia wurde eine Frierzeit pro Zyklus von 15 Minuten festgesetzt.
Verschluss erfolgte nach Spülung der betroffenen Stelle mit isotoner Kochsalzlösung mit 2/0
Seide.
2.3 Magnetresonanztomographie
Sofort im Anschluss an die OP wurden die Tiere mittels tragbarem Beatmungsgerät unter
Aufrechterhaltung der Narkose mit Propofol nach Bedarf und Überwachung mittels
Pulsoxymetrie per Transportwagen in das Institut für Kernspintomographie der Universität
Köln gebracht. Vor Durchführung der Kernspintomographie wurden die Tiere an ein
stationäres Narkosegerät mit Halothanverdampfer angeschlossen. Die Überwachung der Tiere
im Kernspintomographen konnte nur durch einen Tierarzt erfolgen, da alle
Überwachungsgeräte magnetisch waren und deshalb nicht zum Einsatz kommen durften.
Tiere der Gruppen 1-3 wurden mit einer Ausnahme unmittelbar post OP und vor der
Schlachtung mittels Kernspintomographie untersucht.
Tibia und Femur beiderseits wurden mit und ohne Kontrastmittelanreicherung dargestellt und
ausgewertet.
2.4 Röntgendiagnostik
Beide Tibiae und Femora aller Gruppen wurden unmittelbar nach Schlachtung entnommen
und von Weichteilgewebe befreit. Sofort nach der Präparation wurden die Knochen
gekennzeichnet und zur Konservierung tiefgefroren.
Zur Röntgendiagnostik wurden Aufnahmen mit fein-zeichnenden Folien in 2 Ebenen
belichtet: 1. Ebene laterolateraler Strahlengang, 2. Ebene ap.
Die Auswertung der Röntgen- und magnetresonanztomographischen Befunde ist Bestandteil
einer anderen Arbeit und wird hier nicht näher erläutert.
2.5 Testung der biomechanischen Belastbarkeit
Die Tests auf biomechanische Belastbarkeit wurden im Institut für Biomechanik der
Sporthochschule Köln durchgeführt.
Sowohl Kontroll- als auch Versuchsknochen wurden pro Tier getestet und ausgewertet. Auf
das Femur wurde ein Biegemoment im Bereich des kryochirurgisch behandelten Gebietes
bzw. entsprechender Kontrollstelle bis zu dessen Frakturierung ausgeübt und gemessen.
Auf den medialen Tibiakopf wurde eine Kraft bis zur Impressionsfraktur ausgeübt und
gemessen.
2.6 Histologie
2.6.1 Knochenmarker
Zur histologischen Auswertung der Ab- und Umbauprozesse am Knochengewebe und deren
zeitlichen Einordnung wurden Knochenmarker verwendet, die sich in das Knochengewebe
einlagern. Aus jedem Knochen wurde Proben aus dem behandelten Gebiet zur histologischen
Auswertung genommen.
Die Markierung erfolgte durch vier verschiedene Marker:
1. Calceingrün ( Fluorexon)
2. Xylenolorange
3. Alizarinkomplexon
4. Tetrazyklin
Aus Kostengründen konnten nicht alle Tiere mit Xylenolorange und Alizarinkomplexon
behandelt werden; daher wurden 3 Tiere pro Gruppe unter randomisierten Bedingungen
ausgewählt, die zusätzlich zu Calceingrün und Tetrazyklin diese Marker erhielten. An deren
Stelle wurde bei allen anderen Tieren im Wechsel Calcein und Tetrazyklin verwendet.
Die Verabreichung erfolgte subkutan nach Lösung in 2%-iger Bikarbonatlösung (Calceingrün
und Alizarinkomplexon) bzw. sterilem Wasser (Xylenolorange) und Verwendung eines
handelsüblichen Tetrazyklins pro inj. nach folgendem Schema (Tabelle 5, Markernummer
entspricht denen der obigen Ausführung):
Die Farbmarker wurden den Tieren in festgelegten Zeitabständen verabreicht.


Alle Injektionen wurden von allen Tieren gut vertragen; es traten weder Reaktionen an der
Injektionsstelle auf noch wurden systemische Nebenwirkungen beobachtet.
Nach Tötung der Tiere und Extraktion von Tibiae und Femora wurde zuerst die Prüfung der
biomechanischen Belastbarkeit der Knochen durchgeführt. Unmittelbar nach dem Test wurde
aus der Probenlokalisation Gewebsstücke (Knochenzylinder) entnommen, gekennzeichnet
und in Schaffers Reagenz fixiert.
Schaffers Reagenz ist ein Ethanol-Formalingemisch im Verhältnis 2:1 und verhindert –
anders als bei anderen Fixierungsmedien – das Herauslösen der Fluorochrome aus dem
Knochengewebe.
Da auch bei einer Entkalkung des Knochengewebes zur Vorbereitung auf die histologischen
Schnitte mittels EDTA die Knochenmarker in Lösung gehen, musste die Histologie am
Nativpräparat durchgeführt werden. Hierzu wurde die Trenn-Dünnschliff-Technik verwendet.
Folgend wird das Verfahren zur Herstellung von Dünnschliffpräparaten dargestellt
(Abbildung 9).
2.6.2 Trenn-Dünnschliff-Technik (Sandwich-Technik) nach Donath und Breuner (1989).
Die Trenn-Dünnschliff-Technik nach Donath und Breuner wurde zur histologischen
Untersuchung nicht schneidbarer Materialien entwickelt. Mit dieser Methode können
Dünnschliffe von unter 10 µm Dicke von Präparaten erzeugt werden, die mittels
herkömmlicher Mikrotom-Schnitttechnik nicht hergestellt werden können. Als Präparate
eignen sich zum Beispiel zahntragende Kieferabschnitte, Knochengewebe mit oder ohne
Implantat oder ähnlich harte Substanzen.
Zur Herstellung eines Dünnschliffes wurden folgende Materialien verwendet:
Geräte:
• EXAKT-Trennschleifsystem
• EXAKT-Mikro-Schleifsystem
Hilfsgeräte:
• EXAKT-Vakuum-Klebevorrichtung zur planparallelen Aufblockung
• EXAKT-Präzisionsklebepresse für Objektträgermontage
• Kulzer-EXAKT-Lichtpolymerisationsgerät
• Mikrometerschraube
• Fühllehre 0,05 bis 0,50 mm
• Haarlineal
Verbrauchsmaterialien:
• Einbettmedium (Technovit 7.200 VLC, Kulzer)
• Technovit 4000, Kulzer
• Präzisionskleber lichthärtend Technovit 7.210 VLC, Kulzer
• Fixationskleber (Technovit 7.230 VLC, Kulzer)
• Lichtdurchlässige Einbettmulden
• Plexiglas- Objektträger
• Schleifpapier in verschiedenen Körnungen
Sonstiges:
• Glykolmethacrylat
• Eindeckmittel und Deckgläser
• Aceton oder Petroleumbenzin

Nach Gewinnung der Proben wurden diese sofort in ein Fixierungsmedium gegeben.
Die Entwässerung der Proben erfolgte manuell in einer aufsteigenden Alkoholreihe nach dem
üblichen Verfahren. Nach Dehydratation wurden die Proben in den flüssigen
Einbettkunststoff verbracht. Zur Infiltration des Kunststoffes in das Gewebe wurden die
Präparate einige Tage unter Ausschluss von Licht (da der Kunststoff lichthärtend ist)
durchtränkt. Um letzte Lufteinschlüsse zu beseitigen, wurde kurz vor Einbettung eine
Luftextraktion im Vakuum durchgeführt. Anschließend wurden die Proben in Einbettmulden
gegeben und mit flüssigem Kunststoff aufgefüllt. Dabei wurden die Präparate entsprechende
der geplanten Schnittrichtung orientiert. Danach erfolgte die Polymerisation des Kunststoffes
in 2 Schritten: Um Spannungsrisse im Kunststoffblock zu vermeiden, wurde die langsame
Polymerisation unter großem Lampenabstand bei einer Wellenlänge von 400- 500 nm für
etwa 1 Stunde eingeleitet; die Endpolymerisation erfolgt dann bei gleicher Wellenlänge und
Polymerisationstemperatur >40° C für weitere 6 Stunden.
Nach Herauslösen der Blöcke aus den Einbettmulden liegt der schneid- und schliffähige
Einzelblock des Präparates vor (Abbildung 10).

Der Block wurde zur weiteren Bearbeitung auf der Gegenseite der zu untersuchenden Fläche
mittels der Vakuum-Klebepresse mit Technovit auf einen Objektträger aufgeklebt. Der auf
dem Objektträger montierte Kunststoffblock wurde nun im Mikroschleifsystem arretiert und
bei grober Körnung bis auf die gewünschte Präparatoberfläche abgeschliffen. Die gewünschte
Oberfläche wurde dann mit einem feinkörnigen Schleifpapier nachbehandelt, um eine
möglichst glatte Oberfläche zu erhalten. Eventuelle Unebenheiten werden mit einem
Haarlineal kontrolliert. Die Dicke von Objektträger und Block wurde mit einer
Mikrometerschraube gemessen.
Ein weiterer Objektträger wurde vor Aufbringen auf die zu untersuchende Schnittfläche
mittels Mikrometerschraube auf Planparallelität geprüft und die Dicke notiert. Nach
Reinigung von Objektträger und Schnittoberfläche mit Aceton wurde die Schnittoberfläche
mit dem Präzisionskleber versehen und auf den Objektträger in der Vakuum-Klebepresse bei
konstantem Druck aufgeklebt. War das Klebeergebnis zufriedenstellend (keine
Blasenbildung), wurde der Kleber durch Belichtung für 10 Minuten ausgehärtet. Nach
Ausmessung der Dicke des Gesamtblockes incl. Objektträgern ergibt sich rechnerisch die
Dicke der Klebefläche.
Nun wurde der präparierte Block (Sandwich) in dem Trenn-Schleifsystem arretiert und das
Präparat bei einer Vorschubkraft von 50-100 Pond mit einem mit Bornid- oder
Diamantkörnern beschichteten Stahlband auf die voreingestellte Dicke geschnitten.
Die Dicke des Präparates wurde mit einer Mikrometerschraube gemessen. Nach Arretierung
des Schnittes im Mikro-Schleifsystem und Ermittlung des Nullpunktes wurde das Präparat
zuerst bei grober Körnung, später bis zum Erreichen der gewünschten Dicke mit feineren
Schleifpapieren geschliffen. Zur Erhaltung der Fluoreszenz sollten Präparatedicken von 60
µm nicht unterschritten werden.
2.7 Stabilitätsprüfung
Im Vorfeld der Stabilitätsprüfung musste überlegt werden, wie ein Modell verwirklicht
werden kann, in dem sowohl die Durchführbarkeit gewährleistet ist als auch entsprechende
biologische Belastungsmuster im Versuch imitiert werden können. Aus Gründen der
Übertragbarkeit auf biomechanische Verhältnisse im Skelettsystem kam nur eine
Versuchsanordnung in Frage, bei der die gesamte behandelte Fläche und das unbehandelte
umliegende Gewebe mit einbezogen werden können.
In Zusammenarbeit mit Sportmedizinern und Experten auf dem Gebiet der Biomechanik
konnte ein durchführbares Modell für Belastungen des kompletten Knochens entwickelt
werden. Nachgeahmt wurden typische Belastungsmuster, die die realen Kräfte, die auf
Knochen einwirken können, simulieren.
Wir entschieden uns, im Bereich des Femur als Kraft ein Biegemoment einwirken zu lassen;
bei den Tibiae sollte eine Kompressionskraft im Bereich des medialen Condylus einwirken.
Gegeneinander verglichen wurden Kontrollseite und Versuchseite, um eine Aussagekraft pro
Tier und Gruppe treffen zu können. Diese Methode erschien uns am besten geeignet zu sein,
da aufgrund von Inhomogenitäten in der Versuchstiergruppe durch unterschiedliches Gewicht
der einzelnen Tiere und daraus resultierender unterschiedlicher Knochendicke ein direkter
Vergleich innerhalb der Gruppen nicht repräsentativ gewesen wäre.
2.7.1 Versuchsaufbau
2.7.1.1 Mechanische Prüfung der Femora
Die Biegetests der Femora wurden mit der Materialprüfmaschine Z 2.5/ TN 1S der Firma
Zwick GmbH & Co, Ulm, mit einer Prüfkraft von 8-2.500 N bei Zimmertemperatur
durchgeführt. Die Prüfmaschine enthielt eine elektronische Mess- und Regeleinheit. Das
Femur wurde mit der distalen Epiphyse im Abstand von 2 mm zum Bohrloch in einen
Metallzylinder mit den Abmessungen 10 x 10 x 8 cm mit einem Eingussbereich von 7 cm
Durchmesser mit PMMA (Technovit 4004, Heraeus Kulzer GmbH, Wehrheim) eingegossen.
Für den Biegeversuch wurde die Probe horizontal gelagert, so dass das Bohrloch nach oben
zeigte. Der Knochen wurde mit einem konkaven Stempel (0,5 x 2 cm) im Abstand von
9,2±0,8 cm zur Kante des Metallzylinders belastet (Abbildung 11). Nach Aufbringen einer
Vorkraft von 1 N mit einer Geschwindigkeit von 1 mm/min wurde der Femurknochen bei 1
mm/sec bis zum Bruch belastet. Es wurde ein 2,5 kN Kraftsensor benutzt. Gemessen wurden
die absolute maximale Bruchfestigkeit, die maximale Biegefestigkeit und die maximale
Biegefestigkeit relativiert auf das Körpergewicht.

2.7.1.2 Mechanische Prüfung der Tibiae
An der Tibia wurde für die Materialtests die distale Epiphyse entfernt. Die Knochendiaphyse
wurde mit PMMA in einen Metallzylinder mit den Abmessungen 6 x 6 x 7 cm mit einem
Eingussbereich von 3,5 cm eingegossen. Die Materialtests wurden mit einer
selbstkonstruierten Testmaschine durchgeführt. Vortests hatten ergeben, dass keine
Materialprüfmaschine zur Verfügung stand, die die Kraft zur Impressionsfraktur des
Tibiacondylus aufbringen konnte.
An einer Handpresse mit Zahnstange wurde ein 20 kN Quarzkristallsensor, 1-D, Piezo der
Firma Kistler Instrumente GmbH, Winterthur, zur Kraftmessung eingebaut. Die Verformung
wurde mit einem induktiven Wegaufnehmer gemessen. Zur Überwachung und Aufzeichnung
der analogen Daten des Kraft- und Längensensors wurde das Gerät Digiforce 9306 der Firma
Burster Präzisionsmesstechnik, Gernsbach, verwendet. Die Messfrequenz betrug 500 Hz.
Anschließend wurden die Daten computertechnisch erfasst und zur Auswertung geglättet.
Die Probe wurde vertikal auf Kompression mit einem abgerundeten Stempel mit einem
Durchmesser von 15 mm bei einer Fläche von 209 mm 2 belastet (Abbildung 12). Die Kraft
wurde am Tuberculum intercondylare mediale manuell mit etwa 1 mm/sec bis zum Bruch
eingeleitet.
Es wurde die absolute maximale Kompressionsfestigkeit relativiert auf das Körpergewicht
und die maximale Spannung, d. h. die maximale Kompressionsfestigkeit geteilt durch die
Fläche des Stempels, ermittelt.

2.7.2 Statistik
Die statistische Prüfung auf signifikante Unterschiede (p<0,05) erfolgte im Rahmen einer
deskriptiven Analyse mit dem Wilcoxon-Test. Als Statistikprogramm diente SPSS Version
9.0 für Windows.
3 Ergebnisse
Alle operierten Tiere überstanden die Operation ohne größere Komplikationen. Ein Schaf
verstarb kurz nach Narkoseeinleitung ohne ersichtlichen Grund an Herz-Kreislauf-Stillstand
und wurde nicht in die Studie einbezogen.
Eine oberflächliche Wundinfektion im Bereich des rechten Femur mit Nekrose von
Hautanteilen um die Naht trat bei einem Tier auf. Die sekundäre Wundheilung erfolgte ohne
Komplikationen.
Alle Tiere belasteten bereits 2 Tage post OP alle Gliedmaßen ohne Anzeichen einer
Lahmheit.
Zwei Tiere waren ohne unser Wissen zum Zeitpunkt der Operation tragend und abortierten
am Tag nach der OP.
Während der Operation war die häufigste Komplikation das Frieren von Weichteilgewebe,
welches nicht ausreichend geschützt war. Besonders die Heilung der Muskulatur, der Gefäße
und des Bindegewebes verlief spontan und ohne Anzeichen von negativen Auswirkungen auf
das Tier.
Im Bereich der Tibia wurde fast immer die umliegende Haut in Mitleidenschaft gezogen, eine
Heilung erfolgte spontan und ohne Infektionen.
Im Kernspintomograph wurde ein Schaf versehentlich extubiert und musste daraufhin erneut
intubiert werden.
Ein Tier regurgitierte Panseninhalt bei der Prämedikation zur zweiten Kernspintomographie
kurz vor der Schlachtung, was eine Intubation unmöglich machte. Das Schaf wurde aus
Tierschutzgründen notgetötet und war damit für die Kernspinkontrolle verloren.
Die Verabreichung der Farbmarker verlief ohne Abszessbildungen an der Einstichstelle. Die
Marker wurden von allen Tieren gut vertragen.
Insgesamt war die Komplikations- und Infektionsrate trotz einiger ungewollter Frierungen
von Weichteilgewebe gering. Alle Tiere erholten sich gut von der bis zu 6-stündigen
Narkosedauer und liefen nach spätestens 2 Tagen ohne Lahmheitserscheinungen. Auch im
weiteren Verlauf waren keine Verluste durch Spätschäden oder Spontanfrakturen zu
verzeichnen.





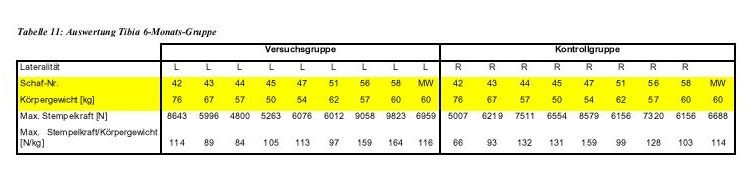






Bei der Auswertung der maximalen Kompressionsbelastung an den Tibiae fand sich bei einer
mittleren benötigten Kraft von 6385,6 N gegenüber durchschnittlich 7483 N (Kontrollseite)
nach Ablauf von 2 Monaten eine signifikante Schwächung der operierten Seite (p<0,034)
(Tabelle 9-Tabelle 11, Abbildung 19-Abbildung 24). Auch die Korrelation der benötigten
Kraft bis zum Eintritt der Fraktur mit dem Körpergewicht (Kg) der Tiere zeigte mit 115,7
N/Kg (rechte Tibia) gegenüber 134,8 N/Kg (Kontrollseite) eine signifikante Schwächung
(p<0,043).
Demgegenüber war die tolerierte Biegebelastung der kryochirurgisch behandelten Femora mit
durchschnittlich 1106,8 N im Vergleich zur Kontrollseite (1193,7 N) nur tendenziell niedriger
(Abbildung 13-Abbildung 18, Tabelle 6-Tabelle 8). Sowohl das absolute Biegemoment (94,6
Nm vers. 110,3 Nm) als das Biegemoment pro Kg/Körpergewicht (1,55 Nm/Kg vers. 1,80
Nm/Kg) zeigten ebenfalls keine signifikanten Unterschied zwischen der behandelten und der
Kontrollseite.
Nach 4 Monaten war die Kompressionsstabilität der behandelten Tibiaköpfe noch immer um
durchschnittlich 517 N bzw. 9 N/Kg niedriger, wobei der Unterschied nicht mehr signifikant
war. Die für den Bruch benötigte Biegebelastung der behandelten Femora war mit 1156,3 N
versus 1181,5 N (Kontrollseite) nahezu gleich. Auch für das maximale Biegemoment und das
Biegemoment im Verhältnis zum Körpergewicht waren praktisch keine Unterschiede
festzustellen.
Sechs Monate postoperativ war die benötigte Stempelkraft bis zum Eintritt der
Kompressionsfraktur auf der kryoabladierten Seite um durchschnittlich 209,6 N bzw. 4,8
N/Kg höher als auf der Kontrollseite, ohne dass dieser Unterschied das Signifikanzniveau
erreicht. Die Messung der Biegebelastbarkeit der behandelten Femora zeigte ähnlich wie die 4
Monate postoperativ durchgeführten Messungen nahezu seitengleiche Verhältnisse, wobei das
behandelte linke Femur minimal weniger belastbar war.
3.2 Histologie
Nach Durchsicht der Präparate unter dem Fluoreszenzmikroskop bei unterschiedlichen
Wellenlängen zeigte sich, dass die erwartete Darstellung von Farbbanden im Knochengewebe
nicht zu erkennen war, vielmehr war ein fließender Übergang zu sehen.
Um dennoch eine histologische Auswertung zu erzielen, wurden die fixierten und archivierten
Restproben aller Tiere lamelliert, in EDTA entkalkt, in Paraffin eingebettet, geschnitten und
einer konventionellen Histologie mit Haematoxylin-Eosin-Färbung unterworfen.
3.2.1 Histologische Auswertung




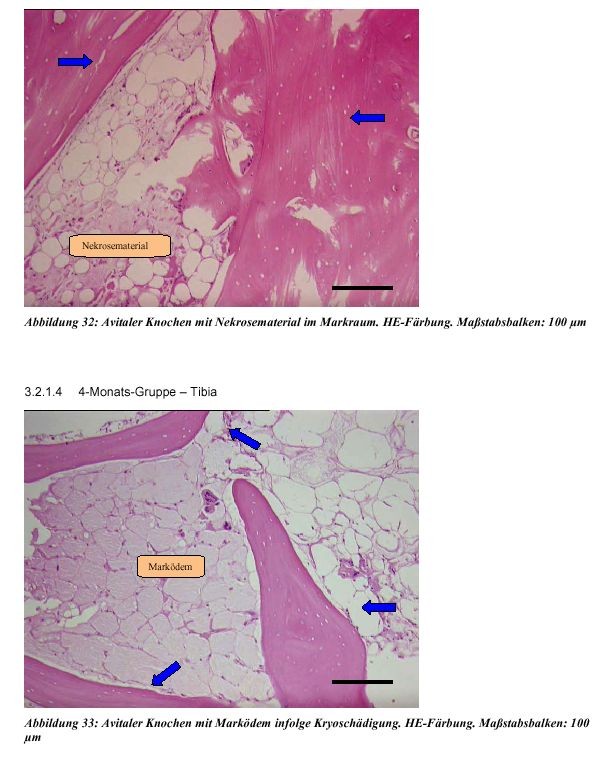




3.3 Praktische Anwendung der Kryochirurgie zur Behandlung eines
Osteosarkoms – Fallberichte
3.3.1 Fallbericht 1
Vorgestellt wurde ein 33 kg schwerer, 6 Jahre alter weiblicher, nicht kastrierter
Boxermischling mit einer mittelgradigen Stützbeinlahmheit vorne links und einer
geringgradigen Umfangsvermehrung im Bereich proximal des linken Karpalgelenks. Die
Lahmheitsuntersuchung bestätigte die Lahmheit vorne links. Palpatorisch konnte eine
Schmerzhaftigkeit im Bereich proximal des Karpalgelenks ausgelöst werden. Die
angefertigten Röntgenaufnahmen zeigten im Bereich des distalen linken Radius einen Verlust
der Kortikalisdichte mit unklar begrenzten Verschattungen im Bereich des umliegenden
Weichteilgewebes. Karpalgelenk und Ulna erschienen röntgenologisch unauffällig. Der
Thorax war röntgenologisch in beiden Ebenen (laterale Aufnahmen rechts und links
anliegend) ohne besonderen Befund.
Das Blutbild war unauffällig. Alle Organparameter befanden sich im Normbereich. Die
alkalische Phospathase war mittelgradig erhöht (660 U/l).
Aufgrund der Verdachtsdiagnose, dass es sich um ein Osteosarkom handeln könnte, wurde
der Patient mittels Computertomographie und Magnetresonanztomographie weiter abgeklärt
(Abbildung 41).

Bei der magnetresonanztomographischen Untersuchung konnten folgende Befunde erhoben
werden:
Es wurden Aufnahmen mit T1-Wichtung und T2-Wichtung inklusive
Kontrastmittelanreicherung angefertigt. Es zeigte sich, dass die Tumorausbreitung am linken
distalen Radius in unmittelbarer Nähe zum Karpalgelenk verlief. Die Ausdehnung der
Neubildung betrug in der longitudinalen Ausbreitung 9 cm, in der diagonalen Ausbreitung
erreichte der Tumor eine Dicke von maximal 3,5 cm Durchmesser. Die Ulna war
offensichtlich nicht betroffen, auch nicht das umliegende Weichteilgewebe. Aufgrund der
morphologischen Veränderungen und der typischen Periostabhebung sprachen die erhobenen
Befunde ebenfalls für das Vorliegen eines Osteosarkoms.
Bei der Bioptatentnahme wurde folgender histologischer Befund erhoben:
Zur Einsendung gelangten zwei grau-beige bis bräunlich gefärbte Gewebsproben. Die Proben
hatten eine Größe von 1,1 x 1,0 x 0,5 cm bzw. 0,6 x 0,3 x 0,3 cm. Das Gewebe war weich-elastisch
und auf der Schnittfläche graurötlich gefärbt.
Für die mikroskopische Untersuchung wurden die Proben halbiert und in toto eingebettet.
Die dabei erhobenen Befunde zeigten, dass die Tumorbildung ganz überwiegend aus unreifen
polymorphen Fibroblasten-ähnlichen Zellen besteht. Von diesen werden überwiegend
proteoglykanartige Substanzen gebildet. Deshalb kommt es im Interzellularraum zu einer
stärkeren Wasserbindung. Daneben zeigen sich aber auch Neubildungen von bälkchenartig
strukturiertem Knochen bzw. von amorphem Osteoid. Aufgrund der zellmorphologischen
Befunde handelt es sich um ein hochmalignes Osteosarkom. Dabei kommt es zu einer starken
Destruktion und Einschmelzung der vorbestandenen Knochenstrukturen. Im Tumor selbst
waren außerdem ausgedehnte Nekrosen und Blutungsfelder erkennbar.
Aufgrund vorliegender Befunde wurde ein kryochirurgischer Eingriff an der betroffenen
Gliedmaße vorgenommen.
Die Prämedikation erfolgte mit 35 mg Diazepam (Diazep von ct ® , ct-pharma), 8,0 ml
Levomethadon (Polamivet ® , Intervet) und 1 mg Atropin via Zentralvenenkatheter; die
Sedation wurde mit Propofol (Rapinovet ® , Essex Tierarznei) nach Bedarf aufrecht erhalten.
Nach Intubation wurde der Hund an eine Druckbeatmung zur Narkose angeschlossen. Der
Sauerstoffflow betrug 8 Liter/min bei einem Mischungsverhältnis mit Isofluran von 4
Volumenprozent über Verdampfer. Die Kontrolle der Vitalfunktionen erfolgte mittels
Kapnographie, Pulsoxymetrie, EKG-Monitoring und viertelstündlichen Blutgasanalysen.
Der Hund wurde prae OP antbiotisch mit 50 mg Amoxicillin (Amoxi Inject ® , WDT) und 200
mg Enrofloxacin (Baytril ® , Bayer Vital) sowie antiphlogistisch mit 250 mg Metamizol
(Vetalgin ® , Boehringer Ingelheim) abgedeckt. Zur Stabilisierung des Kreislaufs wurden 500
ml Ringer-Laktat-Lösung mit Kaliumkorrektur verabreicht.
Die Lagerung erfolgte in Brustlage mit Ausbindung aller Gliedmaßen exklusive der
betroffenen (Abbildung 42). Nach großflächiger zirkulärer Rasur und Desinfektion der
umliegenden Hautpartien sowie steriler Abdeckung des OP-Feldes erfolgte der Hautschnitt
dorsomedial distal beginnend am distalen Rand des Karpalgelenks bis zur Mitte des
Unterarms (Abbildung 43- 44).
Die Präparation erfolgte unter Schonung größerer Gefäße und Nerven; die tiefe Strecksehne
wurde mobilisiert und nach lateral verlagert. In den Radius wurden im Abstand von jeweils 2
cm 5 Bohrlöcher mit dem Durchmesser von jeweils 4 mm monokortikal gebohrt. Das erste
Bohrloch wurde unmittelbar am Gelenkspalt gesetzt, nach proximal wurde ein maximaler
Sicherheitsabstand im gesundem Knochengewebe von 2 cm festgelegt (Abbildung 45).


Nach Einbringen der Kryosonden in den Radius und Vorschieben derselben bis auf die
Gegenkortikalis wurde der Frierzyklus unter größtmöglicher Schonung des umliegenden
Weichteilgewebes begonnen.
Im Zyklus 1 wurde eine Frierung über 3 Minuten bis Erreichen von -180° C vorgenommen
(Messzeitpunkt). Der eigentliche Friervorgang im Zyklus 1 erfolgte über einen Zeitraum von
13 Minuten bei Temperaturen von unter -180° C in allen 5 Sonden. Darauf wurde das Gewebe
etwa 8 Minuten getaut bis zum Erreichen des Nullpunkts.
Im zweiten Zyklus wurden Temperaturen von -180° C nach 40 Sekunden erreicht
(Messzeitpunkt). Der eigentliche Friervorgang in Zyklus 2 erfolgte über einen Zeitraum von
10 Minuten bei -180° C in allen 5 Sonden (Abbildung 46-Abbildung 47). Der Tauvorgang
von Zyklus 2 erfolgte passiv bis zur Möglichkeit der manuellen Entfernung der Sonden
(Abbildung 48).


Der Wundverschluss erfolgte mit Vicryl 2/0; Hautnaht erfolgte mit Prolene 1. Wundschutz
wurde mit Aluspray und abdeckendem Verband sicher gestellt (Abbildung 49).
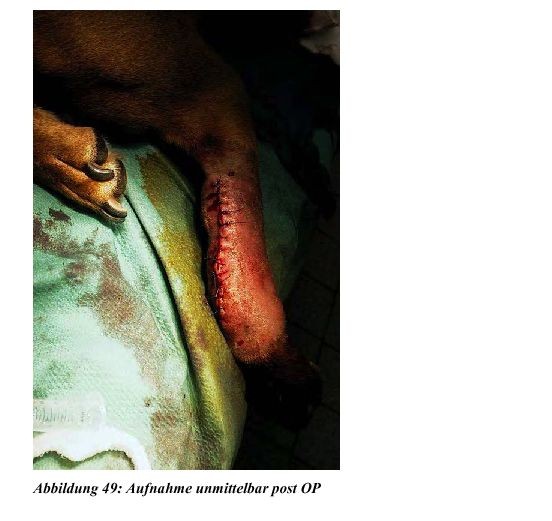
Die unmittelbare postoperative Phase verlief ohne Komplikationen. Der Hund wurde
antibiotisch abgedeckt mit Amoxicillin + Clavulansäure (Synulox ® , Pfizer) und Enrofloxacin
(Baytril ® , Bayer Vital). Als Antiphlogistikum wurde Carprofen (Rimadyl ® , Pfizer)
angewandt.
Ein Verbandswechsel erfolgte in zweitägigen Abständen. Der Allgemeinzustand des Tieres
konnte als sehr gut bezeichnet werden. Die Futteraufnahme war gut und die Besitzer hatten
auf Nachfrage nicht den Eindruck von besonderen Schmerzreaktionen. Die betroffene
Gliedmaße wurde belastet. Im weiteren Verlauf entwickelte sich einige Tage post OP eine
großflächige Nekrose der Haut, die nicht beherrschbar war (Abbildung 50 -Abbildung 53).
Vierzehn Tage post OP musste aus tierschutzrechtlichen Gründen eine Amputation der
Gliedmaße erfolgen. Die Amputation wurde im proximalen Humerusbereich nach den Regeln
der tierärztlichen Kunst vorgenommen. Die Wundheilung erfolgte komplikationslos.
Die betroffene Gliedmaße wurde gesichert und für weitere diagnostische Zwecke in
Formalinlösung fixiert.




Elf Monate post OP wurde der Hund aufgrund von Husten erneut vorgestellt. Die
Röntgenaufnahmen wiesen multiple deutliche Rundschatten im Lungenfeld auf (Abbildung
54). Es musste von Metastasenbildung in der Lunge ausgegangen werden. Es wurde eine
palliative Therapie mit täglicher Gabe von Prednisolon in der Dosierung von 2 mg/kg KG
durchgeführt. Das Tier wurde aufgrund der Lungenproblematik 14 Monate post OP
euthanasiert.

Histologische Auswertung der Gliedmaße:
Bei der nachfolgenden histologischen Auswertung konnten histopathologisch keine
Tumorzellen mehr nachgewiesen werden. Es wurde, wie gewollt, eine ausgedehnte Nekrose
der Tumormasse festgestellt.

Eine kompakte Tumormasse im enchondralen Markraum mit Zerstörung der Spongiosa und
des Knochenmarkes ist zu erkennen. Besonders einseitig (Abbildung 55, Pfeile):
Durchbrechung der Kortikalis und Ausbreitung des Tumorgewebes zwischen
Knochenaußenfläche und angrenzender Skelettmuskulatur. Auf der linken Bildseite: invasives
Vordringen des Tumors.


Histologische Schnittpräparate vom Tumorgewebe 14 Tage nach der kryochirurgischen
Behandlung zeigen Tumorgewebe an der Außenfläche des Radius (Abbildung 56).
Zahlreiche neugebildete Knochenbälkchen aus dem Inneren des Tumors mit deutlicher
Nekrose sind zu sehen (Abbildung 57). Dazwischen zell- und faserreiches Tumorgewebe
ebenfalls weitgehend abgestorben. Stromale Entzündungs- oder Reparationsvorgänge sind in
keiner Lokalisation erkennbar.

In den Knochenbälkchen des Tumorgewebes finden sich nur vereinzelt geschrumpfte
osteozytenartig ausgereifte Tumorzellen bei strukturell weitgehend erhaltener mineralisierter
Knochenmatrix. Im dazwischen gelegenen zellreichen Tumorgewebe: nur noch schattenhaft
Reststrukturen der hier häufiger spindelförmigen Sarkomzellen (Abbildung 58).

In Abbildung 59 links erkennt man eine nekrotische Knochenstruktur aus dem Innenbereich
des Tumors. Alle restlichen Bildteile zeigen nekrotische Weichgewebsanteile mit
vollständiger Auflösung der Zell- und Gewebsstrukturen. Zusätzlich: großflächige, meist
herdförmige dystrophische Kalkausfällungen im nekrotischen Weichgewebe des Tumors
(blaue granuläre Niederschläge).


Randbereiche des Tumors zeigen abgestorbene Knochenbälkchen. Im angrenzenden
Weichgewebe finden sich hochgradig ödematöse Auflockerungen und Emigration von
Entzündungszellen. Dazwischen: abgestorbene Zellanteile des Tumors und Fibrinkondensate
(Abbildung 60- Abbildung 61).

Starke entzündliche Gewebsreaktion an der Außenfläche im Tumor erhaltener Kortikalisteile
zeigt die Abbildung 62. Bei erhaltenen Gefäß- und Faserstrukturen erkennt man wesentlich
stärker ausgeprägte Entzündungsreaktion. Periphere Ausläufer des Osteosarkoms sind nicht
erkennbar.


Unmittelbar an das Tumorgewebe angrenzende Skelettmuskulatur mit starker leukozytär
geprägter Entzündung ist in Abbildung 63 und Abbildung 64 dargestellt. Skelettmuskelfasern
sind überwiegend ebenfalls degeneriert oder fortgeschritten nekrotisch. Muskelzellkerne und
Myofibrillenstruktur sind nicht mehr erkennbar (hyalinschollige Degeneration). Vitale
Tumorgewebsanteile oder einzelne Tumorzellen sind an keiner Stelle erkennbar.
3.3.2 Fallbericht 2
Bernhardiner, weiblich, 10 Jahre alt, 55 kg. Seit etwa ½ Jahr Umfangsvermehrung am rechten
distalen Unterarm, von Kollegen als Verkalkung diagnostiziert, keine Vorbehandlung.
Befunde: Etwa 15 x 15 cm große Umfangsvermehrung proximal des rechten Karpus, im
Röntgenbild etwa 15 x 10 cm große Umfangsvermehrung im Bereich des distalen Radius,
Verlust der Kortikalisdichte und Infiltration ins umliegende Weichteilgewebe; nicht
gelenkübergreifend. Röntgenbild des Thorax rechts und links anliegend ohne besonderen
Befund. Blutbild: normal. Alle Organparameter (Harnstoff, Kreatinin, GPT, GOT, Glucose)
im Normbereich. Alkalische Phosphatase geringgradig erhöht. Verdachtsdiagnose:
Osteosarkom.
Aufgrund der Größe der Tumormasse musste die Operation als palliative Maßnahme gesehen
werden.
Die Narkoseeinleitung erfolgte mit Levomethadon und Xylazin via Venenverweilkatheter;
eine Antibose erfolgte präoperativ mit Amoxicillin i. v. und Enrofloxacin s. c. Nach
Intubation wurde eine Inhalationsnarkose mit Isofluran und Lachgas/Sauerstoff unter
Druckbeatmung eingeleitet. Zur Kreislaufstabilisation wurde Ringer-Lactat verabreicht. Die
Narkoseüberwachung erfolgte mittels Kapnographie und Pulsoxymetrie; die Blutgase wurden
im Abstand von 15 min kontrolliert.
Der operative Zugang erfolgte von dorsomedial. Nach Präparation des Radius wurden im
Abstand von 3 cm 6 Bohrlöcher mit einem Durchmesser von 4 mm in den Radius
eingebracht; das distale Bohrloch befand sich in ummittelbarer Nähe zum Gelenkspalt, das
proximale im Bereich des makroskopisch gesunden Knochengewebes.
Der Frierzyklus wurde dem der Versuchstiere angepasst. Es erfolgten 2 Frierzyklen von
jeweils 10-minütiger Dauer; nach dem 1. Frierzyklus wurde das Gewebe aktiv getaut, nach
dem 2. Frierzyklus passiv. In der Frierzone wurden Temperaturen von -186° C erreicht. Das
umliegende Weichteilgewebe wurde dadurch großflächig mitgefroren inklusive Anteilen der
Haut. Nach 45-minütiger Auftauphase erfolgte die Wundnaht in Schichten mit Vicryl 2/0,
Hautnaht mit Seide 3/0. Es wurden Bioptate aus unterschiedlichen Lokalisationen zur
histologischen Untersuchung genommen. Diagnose: Osteoblastisches Osteosarkom.
Die Antibiose mit Amoxicillin und Clavulansäure sowie Enrofloxacin wurde für 10 Tage
beibehalten, zur Schmerzlinderung erhielt der Patient initial Temgesic und für weitere 10
Tage Carprofen in der Dosierung von 4 mg/kg. Für 10 Tage wurde ein Stützverband angelegt,
der bis über das Ellbogengelenk reichte. Verbandswechsel erfolgten alle 3 Tage; alle 6
Wochen erfolgte eine Röntgenkontrolle.
Durch eine Hautnekrose erlitt der Patient eine Infektion mit einem multiresistenten E. coli, die
nur schwer zu beherrschen war. Während der gesamten Beobachtungszeit trat eine
geringgradige Lahmheit auf, die aber ohne Verabreichung von NSAIDs und ohne größere
Einschränkungen für das Tier blieb.
Bereits 6 Wochen post OP konnte eine signifikante Remission der Tumormasse beobachtet
werden, die sich nach 12 Wochen post OP in geringem Umfang weiter fortsetzte. Nach der
18-wöchigen Kontrolle sistierte die Tumorremission; eine erneute Ausbreitung des
Tumorgewebes konnte aber nicht festgestellt werden (Abbildung 65-Abbildung 71). Aus
Kostengründen und aufgrund der in der Literatur kaum signifikant ansteigenden Survival nach
Chemotherapie mit Cisplatin wurde auf eine Chemotherapie verzichtet. Der Hund starb
unerwartet und plötzlich etwa 24 Wochen post OP. Eine erneute Probeentnahme post mortem
verweigerte der Besitzer. Der Wunsch zur Einäscherung des Tieres wurde respektiert.
Fazit: Die Operation verlief ohne Komplikationen. Im postoperativen Verlauf stellte sich eine
Nekrose der Haut mit einer schwer zu beherrschenden Infektion ein. Die Röntgenaufnahmen
zeigten im Verlauf eine deutliche und anhaltende Remission der Tumormasse. Der Patient
war postoperativ in seiner Lebensqualität nur geringgradig eingeschränkt.




3.3.3 Fallbericht 3
Vorgestellt wurde eine 8-jährige Greyhoundhündin, weiblich, kastriert. Der Hund zeigte seit
einigen Wochen eine rezidivierende Lahmheit hinten rechts. Bei einer röntgenologischen
Untersuchung wurde eine Umfangsvermehrung am distalen rechten Femur festgestellt. Der
Verlust der Kortikalisdichte und die Lokalisation sprachen für das Vorliegen eines malignen
Tumors im Bereich des distalen Femur.
Präoperativ verlief die allgemeine Untersuchung ohne besonderen Befund. Bei der
Lahmheitsuntersuchung zeigte sich eine mittelgradige gemischte Lahmheit hinten rechts.
Auffallend war eine Umfangsvermehrung im Bereich des rechten Karpus, die aber laut
Besitzer schon Jahre bestand und als Arthrose im Karpalgelenk diagnostiziert wurde.
Die Röntgenbefunde des Thorax rechts und links anliegend waren unauffällig (Abbildung 72-
Abbildung 73). Rotes Blutbild, weißes Blutbild und Organparameter waren im Normbereich.
Als Prämedikation wurde Diazepam in der Dosierung von 1 mg/kg KG und Levomethadon
(Polamivet ® , Intervet) in der Dosierung von 0,4 ml/ kg KG via Venenkatheter verabreicht.
Nach Intubation wurde eine Inhalationsnarkose mit Sauerstoff/N2O und Isofluran unter
Druckbeatmung aufrechterhalten. Das Monitoring erfolgte mittels Pulsoxymetrie und
Kapnographie sowie Blutgasanalysen im viertelstündlichen Intervall.
Nach Rasur und Desinfektion des Operationsgebietes erfolgte standardisierter Zugang zum
distalen Femur von lateral und Eröffnung des Kniegelenks mit Luxation der Patella nach
medial. Das Femur wurde großzügig freigelegt, um das Weichteilgewebe effektiv schützen zu
können. Eine Biopsie des veränderten Gewebes wurde entnommen und zur histologischen
Untersuchung gegeben (Diagnose: Osteosarkom).
Im Anschluss wurde das Femur im Bereich des Tumors fenestriert; die Tumormasse wurde
abladiert und der Markraum und Tumorweichteile kurettiert. Durch dieses Verfahren konnte
die Tumormasse um etwa 80% reduziert werden. Danach erfolgte die intramedulläre
Einbringung von Kryosonden proximal und distal der fenestrierten Stelle mit anschließender
Frierung des Knochens unter Temperaturkontrolle mittels Messsonden. Der
Sicherheitsbereich zum gesunden Knochengewebe im proximalen Bereich betrug mindestens
3 cm. Die Friertemperatur im Sicherheitsbereich betrug während des Friervorgangs
mindestens -50° C.
Danach erfolgte ein separater Frierzyklus im Bereich der Fenestrierung mittels Einbringung
einer Kryosonde durch die Gegenkortikalis nach Bohrung im Winkel von 90° zum Femur.
Die Länge der Frierzyklen betrug insgesamt 34 Minuten. Zur Erhöhung der Destruktion
wurden die Sonden aktiv aufgetaut. Während des Friervorgangs wurde größtmögliche
Sorgfalt auf die Schonung des umliegenden Weichteilgewebes durch Wundhaken und -spreizern
gelegt.
Nach dem Auftauen des Knochengewebes wurde die Fenestrierung mittels Knochenzement
(Palacos) zur Stabilisierung des Femur versiegelt. Der Wundverschluss erfolgte mit Vicryl 2/0
und Seide 3/0 (Abbildung 74-Abbildung 78).
Postoperativ wurde eine Antibiose initial mit Amoxicillin in der Dosierung von 15 mg/kg KG
und Marbofloxacin (Marbocyl FD ® , Vetoquinol) in der Dosierung von 2 mg/kg KG
intravenös verabreicht. Schmerztherapie erfolgte initial mit Metamizol (Vetalgin ® ,
Boehringer) in der Dosierung von 50 mg/kg KG intravenös und Temgesic (Human ® , Essex),
1 Ampulle i. m. Die Antibiose wurde für weitere 10 Tage mit Amoxicillin + Clavulansäure
(Synulox ® , Pfizer) in der Dosierung von 12,5 mg/kg oral, 2 x täglich fortgesetzt. Als
Schmerzmittel wurde Meloxicam (Metacam ® , Boehringer) nach Bedarf verabreicht.
Das Fädenziehen erfolgte 10 Tage post OP beim Haustierarzt. Wundheilungsstörungen
wurden nicht festgestellt. Das Allgemeinbefinden und die Futteraufnahme waren gut. Den
Besitzern wurde für den Hund Leinenzwang für die nächsten 4 Monate auferlegt.
In Zusammenarbeit mit dem Institut für Strahlendiagnostik der Universität Bern, Schweiz,
wurde 14 Tage post OP eine Chemotherapie mit Cisplatin nach Standardprotokoll für
Osteosarkome eingeleitet.
Im weiteren Verlauf zeigte der Hund eine zunehmende Schmerzhaftigkeit und komplette
Entlastung der betroffenen Hintergliedmaße. Eine Schmerztherapie erbrachte nur
unzureichende Besserung. Da der Hund auch nach einer Strahlentherapie weiterhin
offensichtliche hochgradige Schmerzreaktionen zeigte, wurde das Tier aus Tierschutzgründen
3 Monate post OP euthanasiert.





4 Diskussion
Nach kryochirurgischer Behandlung treten am Knochengewebe Umbauvorgänge ein, die die
Knochenstabilität und -belastbarkeit verändern. Dies lässt sich sowohl im Rahmen der
Bruchversuche als auch der begleitenden Histologie gut dokumentieren.
Durch die wenigen Berichte von anderen Arbeitsgruppen, die zum Teil von massiven
Stabilitätsproblemen nach kryochirurgischer Behandlung des Knochens im Tierexperiment
berichteten, wurde von uns ein relativ kleiner Knochenabschnitt an Femur und Tibia gewählt,
der kryochirurgisch behandelt wurde.
Bei einem Versuch von Gage et. al. (1966) traten bei insgesamt 11 von 20 Hunden nach
Kryobehandlung am Femur Spontanfrakturen auf, wobei in diesem Fall die gesamte
Zirkumferenz des Femurs auf einer Länge von 4,5-7 cm gefroren worden war. Weitere
Literaturhinweise von Fisher (1978), Keijser et. al.(2000) und Kerschbaumer et. al., (1984)
belegen eine maximale Instabilität des Knochens etwa 8 Wochen nach Kryobehandlung.
Das Ausbleiben von Spontanfrakturen bei den Versuchstieren der vorliegenden Arbeit wird
darauf zurückgeführt, dass im Vergleich zu publizierten Arbeiten nur eine vergleichbar kleine
Fläche an Tibia und Femur zur kryochirurgischen Behandlung gewählt haben. Des Weiteren
ist aber auch hervorzuheben, dass durch die neuartigen Miniaturkryosonden eine sehr gute
Steuerbarkeit des Friervorgangs mit einer deutlichen Begrenzung der Knochennekrose zu
erreichen ist.
Durch den geringen Durchmesser der Sonden ist es möglich, den Verlust an Knochensubstanz
durch Bohrungen zum Einbringen der Sonden zu minimieren. Hierin lag das Problem bei
Keijser et. al. (2000), die eine Kryosonde älterer Bauart mit einem größeren
Sondendurchmesser verwendeten. Bei 31 Ziegen erlitten 3 Tiere am 42., 61. und 62. Tag post
OP Spontanfrakturen.
Die Testung der Tibiakopfkompression gestaltete sich schwierig, da die aufzuwendenden
Kräfte bis zum Eintritt der Impressionsfraktur durch die gängige Materialprüfmaschine, die
auch am Femur verwendet wurde, nicht aufzubringen waren. Deshalb wurde der Bau einer
eigenen Testmaschine notwendig. Da die nötige Kraft bis zum Eintritt der
Kompressionsfraktur stark von der Auflagefläche des Stempels beeinflusst wird, wurde die
maximale Kompressionsfestigkeit pro Stempelfläche (maximale Spannung) berechnet, um die
Werte mit anderen Messungen vergleichbar zu machen.
Besonders im Bereich der Tibia in der 2-Monats-Gruppe zeigte sich am Knochen eine
signifikante Schwächung der Kompressionsbelastung 2 Monate post OP. Es ist zu erwarten,
dass auch am Femur bei Verwendung einer größeren Knochenfläche eine signifikante
Schwächung eingetreten wäre; in diesem Fall jedoch zeigte sich im Bereich des Femurs 2
Monate post OP nahezu die gleiche Festigkeit wie auf der Kontrollseite. Histologisch wird die
Schwächung vor allem im Bereich der Tibia durch die vollständige Apoptose des
Knochengewebes mit zusätzlicher Nekrose von umliegenden Gewebe (Fett- und
Bindegewebe) deutlich. Die Knochenneubildung ist zu diesem Zeitpunkt noch sehr schwach
ausgeprägt, zum Teil sind nur Säume mit vitalen Osteoblasten am avitalen Lamellenknochen
darstellbar.
Nach 4 Monaten post OP zeigte sich im Bereich der Tibia immer noch eine tendenzielle
Schwächung, die aber unterhalb des Signifikanzniveaus liegt. Im Bereich der Femora war die
Biegebelastung zwischen Kryoseite und Kontrollseite annähernd gleich.
Sechs Monate post OP war die benötigte Stempelkraft bis zum Eintritt der
Kompressionsfraktur der kryoabladierten Seite der Tibia tendenziell höher als die der
Kontrollseite. Im Bereich des Femur traten keine nennenswerten Unterschiede auf.
Den praktischen Nutzen am Haustier wird in der zeitlichen Eingrenzung der eingeschränkten
Belastbarkeit post OP gesehen.
Man kann sagen, dass die Gefahr von Spontanfrakturen nach Kryoablation von
Knochengewebe bis 8 Wochen post OP am höchsten ist und danach stark abnimmt.
Da eine komplette Entlastung einer Gliedmaße wie beim Menschen beim Haustier nicht
möglich ist und eine Teilentlastung der betroffenen Gliedmaße mittels Verband sich über
einen langen Zeitraum schwierig gestaltet, ist zu fordern, dass bis mindestens 2 Monate post
OP eine höchstmögliche Ruhigstellung des Tieres und darüber hinaus bis etwa 4 Monate post
OP ein strikter Leinenzwang beim Hund bzw. ausschließliche Wohnungshaltung ohne
Möglichkeit des Hoch- bzw. Herabspringens bei der Katze sicherzustellen ist.
4.1 Histologie
Histologisch zeigt sich korrelierend zu den Bruchversuchen eine deutliche Zunahme und
Anlagerung vitalen Geflechtknochens an den avitalen Lamellenknochen. Man erkennt die
breite Ausbildung neuen Knochengewebes, teilweise mit angrenzender Fibrose. Man kann
davon ausgehen, dass überschießende Reparaturvorgänge für die höhere Stabilität der
kryoabladierten Seite verantwortlich sein müssen.
Infolge des kryochirurgischen Eingriffes kommt es im histologischen Bild zu einer
vollständigen Apoptose des Knochengewebes im betroffenen Gebiet und einer Nekrose von
umliegenden Fett- und Bindegewebe. Teilweise sind Markraumödeme aufgrund der
Schädigung zu finden.
Nach 2 Monaten ist eine ausgedehnte Markraumfibrose zu finden. Bereits jetzt beginnt ein
Neuanbau von Geflechtknochen an den avitalen Lamellenknochen. Der Umbau setzt sich im
zeitlichen Verlauf mit zunehmender Bildung von Geflechtknochen fort. Dabei werden
gleichzeitig verbliebene Nekrosereste durch histiozytär-resorptive Reaktionen abgeräumt.
Teilweise wurden Entzündungszellinfiltrate nachgewiesen.
Insgesamt kann man davon ausgehen, dass im Operationsgebiet eine vollständige Nekrose des
betroffenen Knochengewebes erreicht worden ist. Bereits nach kurzer Zeit beginnt die
Regeneration in Form der Anlagerung von Geflechtknochen an den avitalen Knochen.
Entzündungsreaktionen scheinen nur gering ausgeprägt zu sein. Ein Markraumödem war nur
an einem Präparat nachweisbar. Im zeitlichen Verlauf ist die Größenzunahme des
Geflechtknochens (Knochenaufbau) gut dokumentierbar.
4.2 Fallbeispiele
Drei Hunde mit Osteosarkomen, zwei davon im Bereich des distalen Radius und eines im
Bereich des distalen Femur wurden kryochirurgisch behandelt. Die Tumormasse bei allen
Tieren war erheblich, der Verlauf des Tumors bezog große Teile des betroffenen Knochens
ein. In allen Fällen konnte ein Sistieren der Größenzunahme bis hin zur deutlichen Abnahme
der Tumormasse beobachtet werden. Histologisch konnte an einem Präparat die vollständige
Apoptose der Tumorzellen nachgewiesen werden. Das Allgemeinbefinden der Patienten post
OP konnte in zwei Fällen als äußerst zufrieden stellend bezeichnet werden, in einem Fall
musste die Behandlung aufgrund zu starker Schmerzreaktionen abgebrochen und das Tier
euthanasiert werden.
Bei allen drei Fallberichten bestand die Problematik im Schutz des Weichteilgewebes. Durch
zu starke Weichteilschäden im unmittelbaren Bereich des OP-Feldes kam es zu kaum
beherrschbaren Haut- und Weichteilinfektionen und -nekrosen, die sich in der
Folgebehandlung als äußerst problematisch erwiesen. Betont werden muss, dass diese Fälle
sowohl in Größe als auch in Ausbreitung Sonderfälle darstellen, die chirurgisch wenn
überhaupt nur mittels Amputation therapierbar gewesen wären.
Ungelöst bleibt beim kryochirurgischen Eingriff, wie bei allen anderen chirurgischen
Verfahren, die Problematik der Metastasierung.
Nach Kessler (1999) werden Knochentumore beim Hund in primäre und sekundäre sowie
maligne und benigne Tumore unterteilt. Der Hauptanteil sind primäre maligne
Knochentumoren, wovon Osteosarkome einen Anteil von 85% ausmachen. Osteosarkome
treten zum weitaus überwiegenden Teil bei großen Hunderassen und dort zu 95% im
appendikularen Skelett (Gliedmaßenskelett) auf. Das Durchschnittsalter der betroffenen Tiere
beträgt 7 Jahre; die Rasse scheint nicht so bedeutend zu sein wie Größe und Gewicht des
Hundes. Die typische Primärlokalisation ist die Metaphyse der langen Röhrenknochen.
Ätiologisch werden vor allem Mikrotraumen und Verletzungen der Wachstumszonen als
Auslöser für das Entstehen von Tumoren in Verbindung gebracht. Ein viraler Auslöser wird
diskutiert, bislang mangelt es jedoch an einem Virusnachweis.
Osteosarkome verhalten sich lokal destruktiv und führen zur Zerstörung von Periost und
Kortikalis. Biomechanik und Belastbarkeit können bis hin zu einer pathologischen Fraktur
beeinträchtigt sein.
Osteosarkome metastasieren stark hämatogen, vor allem in das Lungengewebe, aber auch in
alle anderen Organe sowie in das Knochengewebe.
Klinisch zeigen die Tiere eine zum Teil ausgeprägte Lahmheit und Umfangsvermehrung im
Bereich des betroffenen Gebietes. Es kann zu Spontanfrakturen kommen.
Röntgenologisch sind Osteosarkome gut zu diagnostizieren. Typisch ist der ausgeprägte
Kortikalisverlust und das Sunburst-Phänomen, bei dem sich das Periost sonnenstrahlartig
ausbreitet. Ebenso kann oft ein Codmann‘sches Dreieck (Periostneubildung zwischen altem
Periost und Kambiumschicht) nachgewiesen werden. Die Diagnosesicherung kann mittels CT
oder MRT erfolgen, beweisend ist die Tumorbiopsie.
Es stehen verschiedene chirurgische Verfahren zur Behandlung eines Knochentumors zur
Verfügung. Als Standardtherapie wird seit Jahren die Amputation der betroffenen Gliedmaße
gesehen. Selbst große Rassen kommen problemlos mit einer Amputation zurecht und die
Lebensqualität der Tiere ist kaum eingeschränkt. Ohne Chemotherapie beträgt die mediane
Überlebenszeit 3-4 Monate.
Eine Extremitäten-erhaltende Therapie ist die limbsparing-Methode entweder mittels eines
Allografts (Spenderknochen) oder mittels Palacos (Knochenzement), bei der der
tumorbefallene Bereich des Knochens großzügig reseziert und durch ein Implantat überbrückt
wird. Stabilität wird über eine Verbundosteosynthese erreicht. Eine weitere Methode ist das
limbsparing mittels homologem Autotransplantat (Rippenknochen).
Die Komplikations- und Infektionsrate ist relativ hoch. Die mediane Überlebenszeit ist gleich
der der Amputation.
Eine adjuvante chemotherapeutische Behandlung kann die Überlebenszeit signifikant
verlängern. Eine Chemotherapie ohne chirurgische Resektion ist aufgrund der Aggressivität
des Primärtumors nicht sinnvoll.
Zum Einsatz kommen unterschiedliche Chemoprotokolle hauptsächlich mit Platin-Derivaten.
Cisplatin ist nephrotoxisch, so dass eine Diuresebehandlung notwendig ist und myelotoxisch.
Carboplatin ist nur wenig nephrotoxisch, jedoch äußerst myelosuppressiv. Die mediane
Überlebenszeit beträgt etwa ein Jahr. Doxorubicin kann als Monotherapeutikum oder auch in
Kombination mit Platinumverbindungen verabreicht werden. Doxorubicin ist kardiotoxisch.
Lokale Chemotherapeutika in Form von Schwämmchen, die im Bereich des resezierten
Tumors platziert werden wie auch die direkte Applikation von Cisplatin in den betroffenen
Primärtumor führen zu sehr heterogenen Ergebnissen.
Eine Immunotherapie im Anschluss an eine Chemotherapie führt zu signifikant höheren
Überlebenszeiten der Patienten. Hierbei wird als Immunmodulator, der eine Erhöhung der
tumoriziden Monozytenaktivität hervorruft, in Liposomen eingekapseltes Muramyltripeptid-Phosphatidethanolamin
(L-MTP-PE) verwendet.
Die Strahlentherapie wird als palliative Maßnahme angesehen. Da Osteosarkome sehr
strahlenresistent sind, kann nur eine weitgehende Schmerzfreiheit für den Patienten erreicht
werden. Eine Behandlung besteht aus 3 Fraktionen zu je 8-10 Gy an Tag 0, 7 und 21 oder 5
Fraktionen zu je 4,5 Gy an 5 aufeinander folgenden Tagen.
Insgesamt betrachtet stellt der kryochirurgische Eingriff in Verbindung mit einer folgenden
Chemotherapie eine mindestens ebenbürtige chirurgische Variante dar. Es ist die einzige
Extremitäten-erhaltende Methode, bei der ohne Resektion eine vollständige Tumorablation
erreicht werden kann. Wenn im Bereich des Weichteilschutzes Fortschritte erzielt werden
können, stellt die Kryoablation das chirurgische Verfahren mit dem größten Potential dar.
Problematisch bleibt weiterhin die Begrenzung der Frierzone, um umliegendes
Weichteilgewebe zu schonen. Gerade im Bereich der distalen Vordergliedmaße ist ein
effektiver Weichteilschutz kaum möglich. Die Gefahr von Komplikationen wie
Wundinfektionen und Durchblutungsstörungen sowie großflächige Nekrosen im
Operationsgebiet ist hoch und kann in Folge dazu führen, dass eine Amputation
unumgänglich wird. Im Bereich des Femur ist ein deutlich besserer Weichteilschutz aufgrund
großzügiger Präparationsmöglichkeiten gegeben.
Da durch den kryochirurgischen Eingriff bei einem großen Teil der Fälle – besonders bei
noch nicht großflächig ausgebreiteten offensichtlichen Tumoren mit hoher
Wahrscheinlichkeit eine vollständige Apoptose des betroffenen Gebietes erreicht werden
kann, bietet das Kryoverfahren in Kombination mit einer Chemotherapie die beste
Möglichkeit zur Gliedmaßen-erhaltenden Therapie.
5 Zusammenfassung
Die Arbeit befasst sich mit der Entwicklung eines neuartigen kryochirurgischen Verfahrens
zur Behandlung von Osteosarkomen als Alternative zu den bisherigen chirurgischen
Vorgehensweisen. Durch die Entwicklung neuartiger Miniaturkryosonden können die
Steuerung des Friervorgangs und die Kühlleistung optimiert werden. Zur Verwendung kommt
ein neuartiges geschlossenes System mit hochleistungsfähigen dünnkalibrigen Kryosonden.
Im Tierversuch wird das kryochirurgische Verfahren im Hinblick auf Knochenstabilität und
sicherer Apoptose des behandelten Gewebes untersucht. Alle Versuchstiere erreichen nach
dem Eingriff wieder volle Belastbarkeit der betroffenen Gliedmaßen. Spontanfrakturen treten
nicht auf.
Die zu behandelnden Knochen werden auf ihre Belastungsfähigkeit zu unterschiedlichen
Zeitpunkten getestet. Im Bereich des Femur wird ein Biegemoment und im Bereich der Tibia
eine Kompressionskraft ausgeübt. Kontrollseite ist das jeweils korrespondierende gesunde
Femur bzw. die Tibia. Für die Tibiaprüfung wird ein Gerät zur Belastungsfähigkeit
entwickelt.
Die Resultate zeigen eine maximale Instabilität der Tibia und eine geringere, jedoch nicht
signifikante Schwächung des Femur 2 Monate post OP, die sich nach 4 Monaten nur noch
tendenziell im Bereich der Tibia, jedoch nicht mehr am Femur zeigt. Nach 6 Monaten ist die
kryobehandelte Tibia belastbarer als die der Kontrollseite. Erklärbar erscheint dieser Effekt
mit einer überschießenden Regeneration und Reparation des Gewebes.
Zur histologischen Aufarbeitung werden alle Tiere in festgelegten Zeitintervallen mit
Fluorochrommarkierungen versehen, die es möglich machen sollte, die Regeneration des
Gewebes in Abhängigkeit von der Zeit zu dokumentieren. Es wird eine neuartige Technik
verwendet, die eine histologische Aufarbeitung der Präparate ohne vorherige Entkalkung
ermöglicht. Zum Einsatz kommt die Trenn-Dünnschliff-Technik nicht schneidbarer
Materialien nach Donath und Breuner im EXAKT-Trennschleifsystem und EXAKT-Mikroschleifsystem.
Es zeigt sich, dass die histologischen Ergebnisse dieser Methode aus
verschiedenen Gründen nicht auswertbar sind. Nach Entkalkung und HE- Färbung kann
bewiesen werden, dass eine vollständige Apoptose des Knochengewebes im betroffenen
Gebiet erzielt werden kann. Die Regeneration des Knochens kann im zeitlichen Verlauf
dokumentiert werden.
Des Weiteren werden drei Fallbeispiele vorgestellt. Hierbei werden drei Osteosarkome bei
Hunden kryochirurgisch behandelt und im postoperativen Verlauf beobachtet. Trotz
unterschiedlicher Verläufe werden Schwachstellen im Verfahren offensichtlich, die
hauptsächlich im mangelnden Weichteilschutz beim Friervorgang begründet sind. Die
Vorteile liegen in der Remission der Tumormasse bis zum Beweis der vollständigen Apoptose
der Tumorzellen.
Die kryochirurgische Behandlung sollte daher in Zukunft eine ernstzunehmende Alternative
bei Gliedmaßen-erhaltenden Operationstechniken zur Behandlung von Osteosarkomen an
langen Röhrenknochen bei Hunden gesehen werden.
6 Hinweise
6.1 Hinweis auf Teilpublikation
Teile dieser Arbeit wurden 2004 in der Fachzeitschrift „Der Unfallchirurg“ veröffentlicht:
F.Popken, A. Niehoff, F. Emrich, D. Blaecker, M. Bosse, J. Michael, G.-P. Brüggemann, P.
Eysel: Stabilitätsveränderungen nach kryochirurgischer Behandlung an langen
Röhrenknochen – Eine tierexperimentelle Studie. Unfallchirurg 2004 107:113-117
6.2 Beurteilung Histologie Fallbericht 1
Die histologische Beurteilung der dargestellten Präparate im Fallbericht 1 im Kapitel 3.3.1
(„Praktische Anwendung der Kryochirurgie zur Behandlung eines Osteosarkoms“) erfolgte
mit freundlicher Unterstützung durch Herrn Prof. Dr. Siegfried Überschär.
7 Literatur
1. Aboulafia, A. J., Rosenbaum, D. H., Sicard-Rosenbaum, L., Jelinek, J. S., Malawer M.
M.: Treatment of large subchondral tumors of the knee with cryosurgery and
composite reconstruction. Clin Orthop 307: 189 - 189 (1994)
2. Alkalay, D., Kollender, Y., Mozes, M., Meller, I.: Giant cell tumors with intraarticular
fracture. Two-stage local excision, cryosurgery and cementation in 5 patients with
distal femoral tumor followed for 2-4 years. Acta Orthop Scand 67: 291 - 294 (1996)
3. Athanasian, E. A., McCormack, R. R.: Recurrent aneurysmal bone cyst of the
proximal phalanx treated with cryosurgery: a case report. J Hand Surg [Am] 24: 405 -412
(1999)
4. Arnott, J.: On the treatment of cancer by the regulated application of an anaesthetic
temperature. London, J. Churchill (1851)
5. Boons, H. W., Keijser, L. C., Schreuder, H. W., Pruszczynski, M., Lemmens, J. A.,
Veth R. P.: Oncologic and functional results after treatment of giant cell tumors of
bone. Arch Orthop Trauma Surg 122: 17 - 23 (2002)
6. Bradley P. F., Fisher A. D.: The cryosurgery of bone. An experimental and clinical
assessment. Br J Oral Surg 13: 111 - 127 (1975)
7. Cooper, I. S.: Cryogenic Surgery. A new method of destruction or exstirpation of
benign or malignant tissues. New England J Med 268: 743 - 749 (1963)
8. De Vries, J.: Bone marrow embolism and cryosurgery. Thesis, Groningen, (1983)
9. Fay, T.: Early experiences with local and generalized refrigeration of the human brain.
J Neurosurg 16: 239 - 260 (1959)
10. Fisher, A. D., Williams, D. F., Bradley, P. F.: The effect of cryosurgery on the
strength of bone. Br J Oral Surg 15: 215 - 222 (1978)
11. Gage, A. A., Greene, G. W., Neiders, M. E., Emmings, F. G.: Freezing bone without
excision. An experimental study of bone-cell destruction and manner of regrowth in
dogs. JAMA 196: 770-774 (1966)
12. Gage, A. A., Emmings, F. G.: Bone freezing in cryotherapy. J Barnabus Med Center
4: 314-319 (1967 a)
13. Hausamen J. E.: Tierexperimentelle Untersuchungen zur Knochendestruktion und
Regeneration am Kaninchenkiefer nach kryochirurgischer Behandlung. Dtsch
Zahnärztl Z 28: 836 - 43 (1973)
14. Hewitt, P. M., Zhao, J., Akhter, J., Morris, D. L.: A comparative laboratory study of
liquid nitrogen and argon gas in cryosurgery systems. Cryobiology 35: 303-308 (1997)
15. Kerschbaumer, F., Russe, W., Weiser, G., Bauer, R: Cryolesions of bone. An
experimental study. Part I: Examinations in technique of controlled cryolesion on
bone. Arch Orthop Trauma Surg 96: 5 - 9 (1980 a)
16. Kerschbaumer, F., Weiser, G., Neuerer, G. Russe, W., Bauer, R.: Cryolesions of bone.
An experimental study. Part II: Results of cryosurgery on bone. Arch Orthop Trauma
Surg 96: 11 - 14 (1980 b)
17. Kerschbaumer, F., Krösel, P., Schlag, G.: Kryochirurgie des Knochens- Untersuchung
zur Hämodynamik und Gewebetemperatur. Beitr Orthop Traumatol 29: 134 - 139
(1982)
18. Kuylenstierna, R., Nathanson, A., Lundquist, P. G.: Effects of cryosurgery on the
healing pattern of rabbit mandibular bone. A triple fluorochrome labelling study. Acta
Otolaryngol 92: 569 - 574 (1981)
19. Keijser, L. C. M., Schreuder, H. W. B., Buma, P., Weimans, H., Veth, R. P. H.:
Cryosurgery in long bones; an experimental study of necrosis and revitalization in
rabbits. Arch Orthop Trauma Surg 119: 440 - 444 (1999)
20. Keijser, L. C. M., Schreuder, H. W., Doerwald, N., Keulers, B. J., Buma, P., Hulskes,
R., Veth, R. P. H.: Bone strength after cryosurgical treatment of lang bones: an
experimental study in the goat. Vortrag. 10 th Conference of the European Orthopaedic
Research Society, Wiesbaden (2000)
21. Keijser, L. C. M., Van Tienen, T. G., Schreuder, H. W., Lemmens, J. A.,
Pruszczynski, M., Veth, R. P.: Fibrous dysplasia of bone: management and outcome of
20 cases. J Surg Oncol 76: 157-166, Discussion 167 - 1688 (2001)
22. Keijser, L. C. M., Schreuder, H. W., Boons, H. W., Keulers, B. J., Buma, P., Huiskes,
R., Veth, R. P.: Bone grafting of cryosurgically treated bone defects: experiments in
goats. Clin Orthop 396: 215 - 22 (2002)
23. Kessler, M: Kleintieronkologie, Diagnose und Therapie von Tumorerkrankungen bei
Hunde und Katzen: 389-407 (1999)
24. Larrey, D. J.: Surgical Memoirs of Campaigns of Russia, Germany and France.
Translation by J. C. Mercer, Philadelphia, Carey and Le, Philadelphia 1832, S. 293
25. Lenz H., Preussler, H.: The cryoeffect on the growing bone. Laryngol Rhinol Otol 54:
317 - 327 (1975)
26. Malawer, M. M., Marks, M. R., Mc Chesney, D., Piasio, M., Gunther, S. F.,
Schmookler, B. M.: The effect of cryosurgery and polymethylmethacrylate in dogs
with experimental bone defects comparable to tumor defects. Clin Orthop 226: 299 -310
(1988)
27. Malawer, M. M., Dunham, W.: Cryosurgery and acrylic cementation as surgical
adjuncts in the treatment of aggressive (benign) bone tumors. Analysis of 25 patients
below the age of 21. Clin Orthop 262: 42 - 57 (1991)
28. Malawer, M. M., Bickels, J., Meller, I., Buch, R. G., Henshaw, R. M., Kollender, Y.:
Cryosurgery in the treatment of giant cell tumor. A long-term followup study. Clin
Orthop 359: 176 - 188 (1999)
29. Marciani, R. D., White, D. K., Roth, G. I.: Freeze treatment of the monkey mandibular
condyle. J Oral Maxillofac Surg 44: 50 - 59 (1986)
30. Marcove R. C., Miller, T. R., Cahan, W. C.: The treatment of primary and metastatic
bone tumors by repetitive freezing. Bull N Y Acad Med 44: 532 - 544 (1968)
31. Marcove, R. C., Miller, T. R.: Treatment of primary and metastatic bone tumors by
cryosurgery. JAMA 207 (10): 1890 - 1894 (1969 a)
32. Marcove, R. C., Miller, T. R.: The treatment of primary and metastatic localized bone
tumors by cryosurgery. Surg Clin North Am 49: 421 - 430 (1969 b)
33. Marcove, R. C., Lyden, J. P., Huvos, A. G., Bullough, P. B.: Giant-cell tumors treated
by cryosurgery. A report of twenty-five cases. J Bone Joint Surg Am 55: 1633 - 1644
(1973)
34. Marcove, R. C., Weis, L. D., Vaghaiwalla, M. R., Pearson R.: Cryosurgery in the
treatment of giant cell tumors of bone: a report of 52 consecutive cases. Clin Orthop
134: 275 - 289 (1978)
35. Marcove, R. C., Stovell, P. B., Huvos, A. G., Bullough, P. G.: The use of cryosurgery
in the treatment of low and medium grade chondrosarcoma. A preliminary report. Clin
Orthop 122: 147 - 156 (1977 a)
36. Marcove, R. C., Searfoss, R. C., Whitmore, W. F., Grabstald, H.: Cryosurgery in the
treatment of bone metastases from renal cell carcinoma. Clin Orthop 127: 220 - 227
(1977 b)
37. Marcove, R. C.: A 17-year review of cryosurgery in the treatment of bone tumors.
Clin Orthop 163: 231 - 234 (1982)
38. Marcove, R. C., Abou Zahr, K., Huvos, A. G., Ogihara, W.: Cryosurgery in osteogenic
sarcoma: report of three cases. Compr Ther 10: 52 - 60 (1984).
39. Marcove, R. C., Sheth, D. S., Brien, E. W., Huvos, A. G., Healey, J. H.: Conservative
surgery for giant cell tumors of the sacrum. The role of cryosurgery as a supplement to
curettage and partial excision. Cancer 74: 1253 - 1260 (1994)
40. Marcove, R. C., Sheth, D. S., Brien, E. W., Huvos, A. G., Healey, J. H.: Conservative
surgery for giant cell tumors of the sacrum. The role of cryosurgery as a supplement to
curettage and partial excision. Cancer. 74: 1253 - 1260 (1994)
41. Marcove, R. C., Sheth, D. S., Takemoto, S., Healey, J. H. The treatment of aneurysmal
bone cyst. Clin Orthop 311: 157 - 163 (1995)
42. Meals, R. A., Mirra, J. M, Bernstein, A. J.: Giant cell tumor of metacarpal treated by
cryosurgery. J Hand Surg [Am] 14: 130 - 134 (1989)
43. Mirra, J. M., Rand, F., Rand, R., Calcaterra, T., Dawson, E.: Giant-cell tumor of the
second cervical vertebra treated by cryosurgery and irradiation. Clin Orthop 154: 228 -233
(1981)
44. Müller, C., Micksche, M., Yamagata, S., Kerschbaumer, F.: Therapeutic effect of
cryosurgery of murine osteosarcoma. Influence on disease outcome and immune
function. Cryobiology 22: 77 - 85 (1985)
45. Oeseburg, H. B., Rogge, C. W., Schraffordt Koops, H., Oldhoff, J.: Cryosurgical
treatment of aneurysmal bone cysts. J Surg Oncol 10: 9-20 (1978)
46. Pogrel, M. A.: The use of liquid nitrogen cryotherapy in the management of locally
aggressive bone lesions. J Oral Maxillofac Surg 51: 269 - 74 (1993)
47. Pogrel, M. A., Regezi, J. A., Fong, B., Hakim-Faal, Z., Rohrer, M., Tran, C., Schiff,
T.: Effects of liquid nitrogen cryotherapy and bone grafting on artificial bone defects
in minipigs: a preliminary study. Int J Oral Maxillofac Surg 31: 296 - 302 (2002)
48. Popescu, V., Spirescu, I. E.: Bone resection, extra-corporal cryotherapy and immediate
re-implantation in the treatment of mandibular tumours. J Maxillofac Surg 8: 8 -16
(1980)
49. Popken, F., Seifert, J. K., Engelmann, R., Dutkowski, P., Nassir, F., Junginger, T.:
Comparison of iceball diameter and temperature distribution achieved with 3-mm
accuprobe cryoprobes in porcine and human liver tissue and human colorectal liver
metastases in vitro. Cryobiology, Vol 40: 302 - 310 (2001)
50. Popken, F., Land, M., Erberich, H., Bosse, M., König, D. P., Eysel, P.: The use of a
new miniature cryoprobe for ablation of bone tissue: in vivo assessment of the probe
and application of the method to bone in a sheep model. BMC surgery, 3, 3 (2003)
51. Popken, F., Land, M., Bosse, M., Erberich, H., Meschede, P., König, D. P., Fischer,
JH., Eysel, P.: Cryosurgery in long bones with new miniature cryoprobe : an
experimental in vivo study of the cryosurgical temperature field in sheep. Europ J
Surgical Oncol 29: 542 - 547 (2004)
52. Robinson, D., Halperin, N., Nevo, Z.: Two freezing cycles ensure interface
sterilization by cryosurgery during bone tumor resection. Cryobiol 43: 4 - 10 (2001)
53. Russe, W., Kerschbaumer, F., Bauer, R.: Kryochirurgie in der Orthopädie. Orthopäde
13: 142 - 150 (1984)
54. Sampson, D. E., Pogrel, M. A.: Management of mandibular ameloblastoma: the
clinical basis for a treatment algorithm. J Oral Maxillofac Surg 57: 1074 - 1077,
discussion 1078 - 1079 (1999)
55. Salmassy, D. A., Pogrel, M. A.: Liquid nitrogen cryosurgery and immediate bone
grafting in the management of aggressive primary jaw lesions. J Oral Maxillofac Surg
53: 784 - 790 (1995)
56. Schmidt, B. L., Pogrel, M. A. :The use of enucleation and liquid nitrogen cryotherapy
in the management of odontogenic keratocysts. J Oral Maxillofac Surg 59: 720 – 725,
discussion 726-727 (2001)
57. Schneider, U. A.: Experimentelle Untersuchungen des Wachstumsverhaltens von
Röhrenknochen nach Kältebehandlung im Epiphysenbereich. Orthopäde 10: 13 - 18
(1981)
58. Schreuder, H. W. C., Conrad 3 rd E. U., Bruckner, J. D., Howlett, A. T., Sorensen, L.
S.: Treatment of simple bone cysts in children with curettage and cryosurgery. J
Pediatr Orthop 17: 814 - 820 (1997 a)
59. Schreuder, H. W. C., van Beem, H. B., Veth, R. P.: Venous gas embolism during
cryosurgery for bone tumors. J Surg Oncol 3: 196 - 200 (1995)
60. Schreuder, H. W. C., Pruszczynski, M., Veth, R. P., Lemmens, J. A.: Treatment of
benign and low-grade malignant intramedullary chondroid tumours with curettage and
cryosurgery. Eur J Surg Oncol 24: 120 - 126 (1998)
61. Sheth, D. S., Healey, J. H., Sobel, M., Lane, J. M., Marcove, R. C.: Giant cell tumor of
the distal radius. J Hand Surg [Am] 20: 432 - 440 (1995)
62. Tytus J. S.: Further observations on rapid freezing and its possible application to
neurosurgical techniques. Bull Mason Clin 15: 51 - 61 (1961).
63. White, A. C.: Possibilities of liquid air to the physician. J Am Med Assoc 36: 426 -429
(1901)
64. Wittig, J. C., Simpson, B. M., Bickels, J., Kellar-Graney, K. L., Malawer, M. M.:
Giant cell tumor of the hand: superior results with curettage, cryosurgery, and
cementation. J Hand Surg [Am] 26: 546 - 555 (2001)
65. Yun, Y. H., Kim, N. H., Han, D. Y., Kang, E. S.: An investigation of bone necrosis
and healing after cryosurgery, phenol cautery or packing with bone cement of defects
in the dog femur. Int Orthop 17: 176 - 183 (1993)
8 Abkürzungsverzeichnis
Abb. Abbildung
ap anterior-posterior
bzw beziehungsweise
°C Grad Celsius
cm Zentimeter
d.h. das heißt
EDTA Ethylendiamintetraessigsäure
et al. et altera
etc. et cetera
Fig. Figur
Fa Firma
ggr. geringgradig
GOT Glutamatoxalacetattransaminase
GPT Glutamatpyruvattransaminase
Gy Gray
Hz Hertz
i.v. intravenös
Kf molale Gefrierpunktkonstante
kg Kilogramm
KGW Körpergewicht
KJ Kilojoule
kN Kilonewton
L-MTP-PE Muramyltripeptid- Phosphatidethanolamin
ll laterolateral
m Molalität
mg Milligramm
mg/kg Milligramm pro Kilogramm
min. Minuten
ml Milliliter
mm Millimeter
mm 2 Quadratmillimeter
mm/min Millimeter pro Minute
mm/sec Millimeter pro Sekunde
mol/kg Mol pro Kilogramm
MW Mittelwert
N Newton
N/kg Newton pro Kilogramm
nm Nanometer
Nm Newtonmeter
Nm/kg Newtonmeter pro Kilogramm
NSAID non steroidal antiinflammatory drugs
N2O Distickstoffmonoxid
P Dampfdruck
p Irrtumswahrscheinlichkeit
Pa Pascal
post OP post operationem
prae OP prae operationem
pro inj. pro injectionem
s.c. subcutan
Tab. Tabelle
T0 äquilibrierter Gefrierpunkt
U/l Units pro Liter
X molare Fraktion
z.B. zum Beispiel
µm Mikrometer
Share this article / Teilen Sie diesen Artikel
Diese Webseite wurde mit Jimdo erstellt! Jetzt kostenlos registrieren auf https://de.jimdo.com