Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Evaluations of phylogenetic proximity in a group of 67 dogs with
osteosarcoma: a pilot study
Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Canine Periosteal Osteosarcoma
Images added / Abbildungen hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
New subcategory added / Neue Unterkategorie hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
Images added / Abbildungen hinzugefügt 01.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Heart valvular diseases



Dreidimensionale Sonographie der Leber beim Hund

| Author | Peppler, Christine |
| Title | Dreidimensionale Sonographie der Leber beim Hund |
| URL |
http://geb.uni-giessen.de/geb/volltexte/2007/4704 
|
| Publication Date | 2007 |
| Degree | PhD |
| Discipline/Department | FB 10 - Veterinärmedizin |
| Degree Level | doctoral |
| University/Publisher | Universität Giessen |


Aus der Klinik für Kleintiere -Chirurgieder Justus-Liebig-Universität GießenBetreuer: PD Dr. M. Gerwing
Dreidimensionale Sonographie der Leber beim Hund
INAUGURAL-DISSERTATION
zur Erlangung des Grades einesDr. med. vet.beim Fachbereich Veterinärmedizin
der Justus-Liebig-Universität Gießen
eingereicht von
Christine Peppler
Tierärztin aus LichGießen
2007
1 Einleitung
Die dreidimensionale Sonographie wird in der Humanmedizin in vielen Disziplineneingesetzt. Sie bietet die Möglichkeit, horizontale Ebenen von Organen oder Veränderungendarzustellen, die beim zweidimensionalen Ultraschall verborgen bleiben. DurchSensorentechnik ist es möglich, das Volumen von Organen und pathologischenVeränderungen exakt zu bestimmen. Dies wird vor allem bei Verlaufskontrollenherangezogen (Riccabona et al. 1996, Treece et al. 2001, Scharf und Sohn 2002, Strommen et
al. 2004). Ebenso bietet es die Möglichkeit Oberflächen dreidimensional darzustellen. DiesesVerfahren wird in der Gynäkologie und fetalen Missbildungsdiagnostik routinemäßigeingesetzt (Scharf und Sohn 2002).
In der Veterinärmedizin gibt es bislang Ansätze in der Untersuchung mit
dreidimensionalerSonographie sowohl bei Kleintieren (Poulsen Nautrup 2001) als auch bei Pferden (Edinger
und Koneberg 2001, Wagels und Stadler 2004). Allerdings liegen hier nur allgemeineAngaben zu Technik, mögliche Anwendungsgebiete sowie zur Durchführung vor (Poulsen Nautrup 2001). Die vierdimensionale Sonographie als Weiterentwicklung der 3D-Darstellungwird bereits im Bereich der Echokardiographie angewendet (Poulsen Nautrup 2004).
Da bisher noch keine Arbeiten über die dreidimensionale Sonographie der Leber beim
Hundvorliegen, sollen im Rahmen dieser Arbeit grundlegende Voraussetzungen und
Einsatzmöglichkeiten des dreidimensionalen Ultraschalls an diesem Organ beim Hund erarbeitetwerden. Eine wichtige Frage, die in diesem Zusammenhang geklärt werden soll, ist die nachder Notwendigkeit einer Sedation oder Narkose zur Erstellung dreidimensionaler Bilder. DieMöglichkeiten der Bildbearbeitung und die dazu notwendigen Grundlagen sollen ebenfallseruiert werden. Beim Vorliegen von fokalen Leberveränderungen werden ausgehend von denArbeiten von Riccabona et al. 1996, Treece et al. 2001 und Strommen et al. 2004Volumenbestimmungen mit zweidimensionalen und dreidimensionalen Messungendurchgeführt. Die Ergebnisse werden anhand ihrer Auswertbarkeit beurteilt und miteinanderverglichen. Es soll geklärt werden, unter welchen Umständen eine dreidimensionaleVolumetrie durchführbar und ein routinemäßiger Einsatz im Klinikbetrieb möglich ist, z. B.als Kontrolluntersuchung während einer Chemotherapie eines Lebertumors oder zur Planungeines operativen Eingriffs. Dies stellte eine deutliche Erweiterung der bildgebendenDiagnostik dar, ohne die z. B. bei CT-Untersuchungen unvermeidliche Strahlenbelastung.Diese Arbeit soll als Anleitung zum dreidimensionalen Ultraschall der Leber des Hundesdienen und eine Grundlage für weitere 3D-Projekte darstellen.
2 Schrifttum
2.1 Allgemeine Sonographie
2.1.1 Physikalische Grundlagen
Bei der Sonographie werden Schallwellen in sichtbare Signale umgewandelt. Als Ultraschallwerden Schallwellen oberhalb der menschlichen Hörgrenze bezeichnet, die bei 20 kHz liegt.In der bildgebenden Diagnostik kommen Ultraschallfrequenzen von 2,5 MHz oder höher zumEinsatz. Durch Anlegen einer Spannung an polar gebaute Kristalle (z. B. Bariumtitanat) werden diese aufgrund des inversen piezoelektrischen Effektes in mechanische Schwingungenversetzt. Diese Schwingungen breiten sich wellenförmig aus (Dobrinski und Kremer 1988).Durch den piezo-elektrischen Effekt sind die Kristalle auch in der Lage, Schallwellen aus derUmgebung aufzunehmen und in elektrische Impulse umzuwandeln. Diese elektrischenImpulse werden auf einem Monitor als Bildpunkte dargestellt (Kaarmann und Wessels 1991).
2.1.1.1
Artefakte
Artefakte sind Bildfehler, die durch Abweichungen von den idealen Grundannahmen, bedingtdurch biologische Medien, hervorgerufen werden. Die Artefaktentstehung hatunterschiedliche Ursachen. Zum einen sind sie technisch/physikalisch bedingt und damitunvermeidbar. Sie können aber auch andererseits durch schlechte Patientenvorbereitung oderdurch fehlerhafte Geräteeinstellung entstehen. Das Auftreten eines bestimmten Artefaktes,z. B. der distalen Schallverstärkung bei zystischen Gebilden, kann von diagnostischer Hilfesein (Kaarmann und Wessels 1991).
2.1.1.1.1
Schallschatten
Treten im Gewebe hohe Impedanzsprünge auf, kann es zu einer Totalreflexion (z. B. bei Luft)kommen. Daraus ergibt sich, dass hinter diesen Grenzflächen keine verwertbarenSchallwellen mehr auftreten und keine Signale zurückgesendet werden, Strukturen also nichtmehr sichtbar sind (Kaarmann und Wessels 1991).
2.1.1.1.2. Distale
Schallverstärkung
Schallwellen verlieren beim Durchdringen von Flüssigkeiten keine Energie. Daher ist dasEcho distal von Flüssigkeiten energiereicher als unterhalb von Gewebe in gleicher Tiefe. Aus diesem Grund erscheint Gewebe hinter Flüssigkeiten auf dem Monitor echoreicher alsbenachbartes identisches Gewebe (Kaarmann und Wessels 1991, Michele 2000).
2.1.1.1.3 Spiegelartefakt
Dieses
Artefakt entsteht in erster Linie an stark reflektierenden Grenzflächen. Bei derabdominellen
Sonographie ist hier der Zwerchfellbereich mit angrenzender Lungenoberflächezu nennen. Daran
werden die Ultraschallwellen zur Leber hin abgelenkt, um dort erneutreflektiert zu werden.
Aufgrund der längeren Laufzeit errechnet der Computer Lebergewebekranial des Zwerchfells und
projiziert es an diese Position auf dem Monitor (Kaarmann und
Wessels 1991, Barr 1992, Gladisch
1992).
2.1.1.1.4
Tangentialphänomen
Treffen
Schallwellen tangential auf ein Objekt, können diese so gebeugt und gebrochenwerden, dass keine
Reflexion zum Schallkopf erfolgt. Dies tritt häufig bei zystischenGebilden auf, deren seitliche
Pole dann echolos erscheinen (Kaarmann und Wessels 1991,
Michele
2000).
2.1.1.1.5 Artefakte beim dreidimensionalen
Ultraschall
Bei der
Erstellung von dreidimensionalen Ultraschallbildern treten spezifische Artefakte auf
(Nelson et al. 2000). Die Entstehung dieser Artefakte ist während der Erfassung der Rohdatenoder bei der Bildbearbeitung möglich (Downey et al. 2000, Nelson et al. 2000). Manunterscheidet je nach Entstehungsursache Artefakte, die im zweidimensionalen Bild bereitsvorhanden sind, von Artefakten, die bei der Anfertigung des dreidimensionalen Bildesauftreten können (Nelson et al. 2000).
Die ausschließlich beim dreidimensionalen Ultraschall auftretenden Artefakte können in
dreiUrsachengruppen unterteilt werden. Akquisitionsartefakte entstehen durch direkte oderindirekte Bewegungen (Atmung, Gefäßpulsation) des Patienten oder durch falsche Positionder Scan-Ebene (Nelson et al. 2000). Um diese Artefakte zu vermeiden, darf sich der Patientwährend der Abtastung nicht bewegen. Die Aufnahme erfolgt während einer Atempause,damit keine Unschärfen oder „Bildsprünge“ entstehen. Aus dem gleichen Grund muss derSchallkopf ruhig geführt werden (Poulsen Nautrup 2001, Downey et al. 2000, Bailey et al.
2001). Artefakte, die durch eine solche Bewegungsunschärfe entstehen, können direkt bei derUntersuchung erkannt werden. In diesem Fall ist unverzüglich ein erneuter
Versuch notwendig (Nelson et al. 2000). Bei Erstellung der Rohdaten mit Hilfe eines magnetischenSensors ist darauf zu achten, dass Materialien, die den Magneten beeinflussen können, ausdiesem Gebiet entfernt werden (Downey et al. 2000, Nelson et al. 2000). Die Rendering
Artefakte treten im Rahmen der Bildbearbeitung auf. Sie werden durch die Einstellung derRendering Parameter wie Threshold und Opacity etc. beeinflusst. Da diese Artefakte währendder Bildbearbeitung entstehen, lassen sie sich direkt erkennen und rückgängig machen.Bleiben diese Artefakte jedoch im Bild bestehen, ist es bei einem fertig gestellten Bildschwierig, solche Veränderungen als Artefakte zu erkennen (Nelson et al. 2000). Es ist bei derBildrekonstruktion zu beachten, dass Artefakte im Bild auftreten, deren Ursache in dieserBearbeitung nicht erscheinen (Nelson et al. 2000, Bailey et al. 2001). Die Erstellungsartefakte werden durch den Einsatz des elektronischen Skalpells erzeugt. Durch zu starkenEinsatz können diagnostisch wichtige Bereiche des Volumens mit entfernt werden (Nelson et
al. 2000). Zur Sicherung einer Diagnose müssen alle Orginalebenen mit einbezogen werden
(Nelson et al.
2000).
2.1.2 Technische
Grundlagen
2.1.2.1 Allgemeine
Grundlagen
2.1.2.1.1
Bildarten
Historisch gesehen ist als erstes der A-Mode (Amplituden-Mode) zu nennen. Er entstehtdurch ein einzelnes Kristall, das Impulse aussendet und die entsprechenden Echos vonGrenzflächen empfängt. Diesen Echos werden Laufzeiten zugeordnet und es entsteht eineFolge von Amplituden. Wird das Echo nicht als Amplitude, sondern als Bildpunkt mitentsprechendem Helligkeitswert dargestellt, spricht man von B-Mode (Brightness-Mode).Wenn man eine Bildzeile eines solchen B-Bildes mit einer Zeitachse versieht, erhält man denso genannten M-Mode (Motion-Mode) (Kaarmann und Wessels 1991, Gerwing 1989,
Gerwing 1993a, Dudwiesus 1995, Michele
2000).
2.1.2.1.2
Schallkopftypen
Bei einem
Linearscanner sind die Piezokristalle in einer Reihe nebeneinander angeordnet.Dadurch erhält man ein Bild mit parallelen Bildzeilen. Dieser Schallkopftyp ist besonders gutfür oberflächliche Strukturen geeignet, da bereits schallkopfnah ein breiter
Bildausschnitt
vorliegt (Kaarmann und Wessels 1991, Gerwing 1989, Gerwing 1993a, Dudwiesus 1995,
Michele 2000).
Sektorscanner enthalten meist nur einen Kristall, von denen Impulse in verschiedeneRichtungen abgegeben und wieder empfangen werden. Dadurch entsteht ein Bild, das einemKreisausschnitt gleicht und in der Tiefe divergierend breiter wird (Kaarmann und Wessels
1991, Gerwing 1989, Gerwing 1993a, Dudwiesus 1995, Michele
2000).
Sind in
einem Schallkopf mehrere Kristalle bogenförmig nebeneinander angeordnet, sospricht man von einem
Konvexschallkopf. Dieser liefert einen divergierenden Bildausschnittmit einer breiten Ankopplungsfläche, die von der Länge des Transducers bestimmt wird
(Kaarmann und Wessels 1991, Gerwing 1989, Gerwing 1993a, Dudwiesus 1995, Michele
2000).
2.1.2.1.3
Verstärkung
Man
unterscheidet am Ultraschallgerät die Gesamtverstärkung und die tiefenabhängigeVerstärkung (TGC
- Time Gain Control). Mit Ersterer wird die Helligkeit des ganzen Bildesgesteuert, bei der tiefenabhängigen Verstärkung ist es möglich in verschieden anwählbarenTiefen die Helligkeit unterschiedlich einzustellen (Kaarmann und Wessels 1991, Gerwing
1989, Gerwing 1993a, Dudwiesus 1995).
2.1.2.1.4
Auflösung
Die
Auflösung gibt an, bei welchem Abstand zwei gleichartige Objekte noch getrenntdargestellt werden
können. Grundsätzlich gilt, dass bei höherer Frequenz dasAuflösungsvermögen zunimmt (Kaarmann und Wessels 1991, Gerwing 1989, Gerwing
1993a, Dudwiesus 1995, Michele
2000).
2.1.2.2 Technische Grundlagen des dreidimensionalen
Ultraschalls
2.1.2.2.1
Aufnahmetechnik
Die
Voraussetzungen für die Erstellung eines dreidimensionalen Ultraschallbildes ist dieMöglichkeit,
dem zweidimensionalen Bild eine dritte Ebene per Computerberechnunghinzuzufügen.
Dazu müssen Schallkopfposition und die Winkel aller 2D-Bilder bekannt sein. DieErstellungszeit hat einen erheblichen Einfluss auf die Bildqualität (Downey et al. 2000).Es bestehen mehrere Möglichkeiten der Aufnahmetechnik. Bei einer Defokussierungslinsewerden die Schallwellen durch eine vorgeschaltete Linse zerstreut, so dass mehrere Schichtenabgebildet werden. Die Freihandtechnik ohne Positionssensor senkrecht zur 2D-Ebene lässtkeine Messung zu, da der Abstand der Bilder zueinander nur geschätzt wird. Demgegenübererlaubt die Freihandtechnik mit Positionssensor eine exakte Volumenbestimmung. Dazukönnen elektromagnetische Sensoren verwendet werden, die innerhalb eines Magnetfeldesbewegt werden. Ebenso besteht die Möglichkeit mit Infrarotsensoren zu arbeiten. Der
integrierte 3D-Schallkopf enthält einen Motor, der die Ablenkung in der 3. Dimensionmechanisch durchführt (Downey et al. 2000, Sakas et al. 2000, Köstering et al. 2002, Fenster
und Downey 2003).
2.1.2.1.2
Bildrekonstruktion
Durch
leistungsstarke Rechner konnte die Rekonstruktionszeit eines 3D-Bildes deutlichreduziert werden.
Mit dem „surface rendering“, der multiplanaren Reformation und der
transparenten Darstellung stehen drei Möglichkeiten der dreidimensionalen Darstellung zurVerfügung. Die Abbildung der Oberfläche („surface rendering“) entsteht durch dasÜbereinanderlegen von mehreren Konturechos, aus denen eine Oberfläche rekonstruiert wird.Voraussetzung ist ein hoher Impedanzsprung zwischen den Grenzflächen (z. B. Fruchtwasser/Gesicht). Daraus resultiert der bevorzugte Einsatz in der Geburtshilfe zur Abbildung undBeurteilung des fetalen Gesichtes (Köstering et al. 2002). Die multiplanare Reformationerstellt ein dreidimensionales Bild durch drei orthogonal zueinander stehende Ebenen. DieseEbenen können durch den Untersucher beliebig verschoben werden. Eine solche Art derBildrekonstruktion ist sehr schnell und einfach durchführbar (Downey et al. 2000, Fenster
und Downey 2003). Eine Kombination des surface rendering und der multiplanarenReformation ist durch moderne Technologie inzwischen möglich (Downey et al. 2000). ImFalle
der transparenten Darstellung (volume rendering, Volumenscan) werden alleinneren Strukturen dreidimensional auf dem Bildschirm sichtbar. Um eine räumlicheVorstellung auf dem Bildschirm zu erleichtern, kann man die Bilder rotieren oder in einerVolumenbox platzieren. Zusätzlich ist es möglich, durch Wahl der TransparenzparameterStrukturen unterschiedlich darzustellen (Downey et al. 2000, Sakas et al. 2000, Poulsen
Nautrup 2001, Köstering et al. 2002, Mattoon et al. 2002, Scharf und Sohn 2002, Fenster
und
Downey 2003).
2.2 Anwendungsmöglichkeiten der dreidimensionalen Sonographie
2.2.1 Humanmedizin
Der
Beginn des dreidimensionalen Ultraschalls liegt in der Mitte der siebziger Jahre des 20.Jahrhunderts. Seit 1989 stehen Ultraschallgeräte mit 3D-Technologie in der Anwendung
(Brandl et al. 1999). Die Häufigkeit des Einsatzes im klinischen Alltag stieg mit verbesserterComputerleistung. Zu Beginn dauerte die Rekonstruktion eines dreidimensionalen Bildes ca.eine Stunde. Seit 2000 ist es möglich die Zeit als 4. Dimension mit einzubeziehen (4DUltraschall)
(Köstering et al. 2002).
Die Möglichkeit der dreidimensionalen Darstellung im Ultraschall findet ihren
häufigstenEinsatz in der Gynäkologie und der Geburtshilfe (Downey et al. 2000). Erste Arbeiten liegenvon Sohn et al. (1988) vor, in denen sie über die dreidimensionale Darstellung in derUltraschalldiagnostik berichten. Inzwischen wird eine dreidimensionale Darstellung vonMammatumoren und Ovarialtumoren zur Dignitätseinschätzung herangezogen (Scharf und Sohn 2002). Ebenso können Uterusanomalien durch die Schnittbildanalyse besser aufgezeigtwerden (Scharf und Sohn 2002).
In der Embryologie liegt der Einsatz hauptsächlich in der pränatalen
Missbildungsdiagnostik.So kann z. B. das fetale Gehirn durch diese nichtinvasive Technik
dargestellt werden (Monteagudo et al. 2000, Pooh und Pooh 2001). Die dreidimensionale Untersuchung des fetalenHerzens erleichtert die Diagnosestellung im Falle von Missbildungen (Li und Sanders 1999, Bega et al. 2001).
In der allgemeinen Gefäß- und Herzdiagnostik werden 3D-Untersuchungen in Ergänzung
des2D-Modes zur Volumenbestimmung eines Ventrikels herangezogen (Nadkarni et al. 2000).Auch andere Organe, wie z. B. die Prostata, können mittels 3D-Untersuchung in ihrem Volumen bestimmt werden,
so dass pathologische Volumenzunahmen leicht zu identifizieren sind (Fenster und Downey
2003).
Dreidimensionale Untersuchungen der Leber dienen in der Humanmedizin in erster Linie
zurVolumetrie. Dabei wird entweder die Leber als Gesamtorgan gemessen oder es werden
fokaleVeränderungen in ihrem Volumen bestimmt (Hausken et al. 1998, Lang et al. 1999, Rose et
al. 2001a, Rose et al. 2001b). Wagner et al. konnten in einer Studie 1994 zeigen, dass in 28 %der durchgeführten Sonographien bei Lebertumoren oder Gallengangsveränderungen die 3DDarstellung bessere
Informationen lieferte als die 2D-Sonographie. Zusätzlich wurdefestgestellt, dass sich bei
diffusen Lebererkrankungen keine weiteren Verbesserungen durchdie 3D-Diagnostik
ergeben.
Die digitale Erstellung eines dreidimensionalen Bildes aus einer zweidimensionalenUntersuchung nimmt dem Untersucher diese mentale Arbeit ab. Ebenso ist die Möglichkeitder dreidimensionalen Volumetrie verschiedener Organe aufgrund der größeren Genauigkeitder zweidimensionalen Volumetrie vorzuziehen (Fenster und Downey, 2003).Vorteil und Nutzen des dreidimensionalen Ultraschalls gegenüber dem zweidimensionalenwerden in der Humanmedizin durchaus in Frage gestellt (Scharf et al. 2001).
2.2.2 Veterinärmedizin
Zum
jetzigen Zeitpunkt liegen nur vereinzelte Arbeiten über eine Anwendung desdreidimensionalen
Ultraschalls beim Tier vor. In erster Linie handelt es sich dabei umexperimentelle Forschungen
für die Humanmedizin. Es wurden 3D-Aufnahmen vom Gehirndes Affen (Tokuno und Chiken 2004) und vom Hundeherzen erstellt (Suematsu et al. 2003).Trotz
der höheren Kosten wird auch in der Veterinärmedizin immer mehr mit derdreidimensionalen
Ultraschalltechnik gearbeitet. So sind im Bereich der Sehnendiagnostikbeim Pferd mit Hilfe des
Panoramabildverfahrens und der dreidimensionalen Darstellungexakte topographische Übersichten
des gesamten Sehnenapparates möglich (Wagels und Stadler 2004). Weitere Studien wurden im Bereich der Gelenksonographie bei Pferdendurchgeführt (Edinger und Koneberg 2001). Im Rahmen der Echokardiographie ergibt sichdurch die dreidimensionale Sonographie eine bessere Beurteilung der Morphologie und derInterpretation von Messungen (Poulsen Nautrup 2004).
Ein veterinärmedizinisches Lehrbuch für Ultraschalldiagnostik bei Hund und Katze
enthältein Kapitel über dreidimensionalen Ultraschall. Genaue Angaben zum
Untersuchungsgangund zu den Anwendungsmöglichkeiten fehlen (Poulsen Nautrup 2001). Es werden Problemedurch Bewegungsartefakte wie Unschärfe oder Bildsprünge angesprochen, aber nicht näherausgeführt. Die Autorin empfiehlt, zur Scananfertigung Mund und Nase des Tieres kurzzeitigzu verschließen, um einen vollständigen Scan zu erhalten. Die benötigte Scanzeit wird mit 2-5Sekunden angegeben (Poulsen Nautrup 2001).
2.3 Sonographie der Leber
2.3.1 Zweidimensionale Sonographie in der Humanmedizin
In der
Humanmedizin steht die Sonographie als bildgebendes Verfahren aufgrund ihrerSensitivität an
erster Stelle zur Diagnostik von Lebererkrankungen. Als Indikationen für eineLebersonographie
sind in erster Linie eine Erhöhung der Leberenzyme, Ikterus, Schmerzenim Oberbauch und ein
pathologischer Palpationsbefund zu nennen. Zusätzlich wird dieSonographie beim Tumorstaging und
zur Verlaufskontrolle bei Tumorerkrankungeneingesetzt. Die ultraschallgezielte Punktion der
Leber erweitert die Diagnostikmöglichkeiten.Im Rahmen einer sonographischen Leberuntersuchung
werden Kontur und Textur des Organssowie Gallenwege und Gefäße beurteilt.
In der Regel ist die Leber der sonographischen Untersuchung gut zugänglich, ggf. ist einetiefe Inspiration des Patienten notwendig. Zum Durchmustern werden parallele und gekippteSerienschnitte angelegt. Es werden Curved- oder Sektortransducer (3,5-5 MHz) verwendet.Zur Abbildung der Leberoberfläche ist eine höherfrequente Linearsonde (5-10 MHz) vorteilhaft (Strohm und Gladisch 1992, Schuler und Börner 2001).
2.3.2 Zweidimensionale Sonographie in der
Veterinärmedizin
Die sonographische Darstellung der Leber wird in der Veterinärmedizin seit Ende dersiebziger Jahre des vergangen Jahrhunderts eingesetzt (Gerwing 1993b, Selcer 1995). Heuteist sie eine der wichtigsten Methoden zur Diagnostik abdomineller Erkrankungen beimKleintier (Gerwing 1993b, Lamb 1995). Die Indikationen sind z.B. der Verdacht einerLebererkrankung (Leberwerterhöhung, Ikterus) sowie ein abnormer Palpations- oderRöntgenbefund (Gerwing 1993b, Selcer 1995). Mit diesem nichtinvasiven Untersuchungsverfahren können das Leberparenchym, das biliäre System und die Lebergefäße dargestelltwerden. Zur weiterführenden Diagnostik besteht die Möglichkeit, Feinnadelbiopsien ausLäsionen unter sonographischer Kontrolle gezielt zu entnehmen (Gerwing 1993b, Partington und Biller 1996). Die Untersuchung der Leber bei Hund und Katze erfolgt in Rücken- oderSeitenlage. Der Schallkopf wird für die Leberuntersuchung direkt kaudal des Processusxiphoideus aufgesetzt (Gerwing 1993b, Partington und Biller 1996, Barr 1992, Lamb 1995, Nyland et al. 2002b). Der Magen muss während der Untersuchung leer sein, umÜberlagerungen und Gasartefakte zu vermeiden. (Barr 1992, Gerwing 1993b, Lamb 1995, Selcer 1995, Partington und Biller 1996, Nyland et al. 2002b). Die Lebersonographie wirdauch bei Pferden und Rindern als ergänzende bildgebende Diagnostik herangezogen. Vorine allem der Vorteil der gezielten Probenentnahme erleichtert die Diagnosefindung. Beim Pferdkönnen allerdings nur kleine Teile eingesehen werden, da die übrigen Bereiche von Lungeund Kolon überlagert sind (Braun 1997, Reef 1998).
2.3.3 Anatomie der Leber beim
Hund
Die Leber
liegt beim Hund fast vollständig im intrathorakalen Teil der Bauchhöhle. Diekonvexe Facies
parietalis liegt dem Zwerchfell an. Links grenzt der Magen an die Leber,kaudo-lateral die rechte
Niere, kaudal der kraniale Teil des Pankreas und Abschnitte desDuodenums.
Beim Hund teilt sich die Leber in einen Lobus sinister und dexter, mit jeweils einem
medialenund lateralen Anteil. Dazwischen liegen der Lobus quadratus und die Gallenblase. Dorsal
derLeberpforte ist der Lobus caudatus zu finden.
Die Gallenblase (Vesica fellea) liegt in der Fossa vesicae felleae und ragt
nicht über den Randder Leber hinaus. Der Ausführungsgang der Gallenblase (Ductus cysticus)
verbindet sich inder Leberpforte mit weiteren Gallengängen zum Ductus choledochus.Das nutritive Gefäß der Leber (A. hepatica propria) und das funktionelle Gefäß (V. portae)treten durch die Leberpforte in die Leber ein. Die Lebervenen verlassen das Organ an derZwerchfellfläche und münden direkt in die Vena cava caudalis (Nickel et al. 2004).
2.3.4 Sonographisches Bild der physiologischen Leber beim Hund
Die Leber des Hundes weist sonographisch ein homogenes, echoarmes Parenchym auf. IhreEchogenität wird während der Untersuchung mit der angrenzender Organe verglichen. ImParenchym sind zwei Arten von Gefäßen sonographisch differenzierbar, Lebervenen undPortalvenen. Die Portalvenen sind, bedingt durch Fett und Bindegewebe, reflexreich begrenzt(Uferbefestigung). Arterien und Gallengänge sind bei einem gesunden Hund im Ultraschallnicht darstellbar.
Die
Gallenblase liegt rechts der Medianen als reflexloses, rundliches Gebilde mit dorsalerSchallverstärkung und weist beim gesunden Tier eine mittelgradige Füllung auf (Barr 1992, Stünzel 1994, Gerwing 1993b, Lamb 1995, Selcer 1995, Burk und Ackermann 1996, Partington und Biller 1996, Hittmair 1997, Nyland et al. 2002b, Peppler et al.
2005).
2.3.5 Sonographisches Bild von Leberveränderungen beim Hund
2.3.5.1 Fettleber
Die Leber
ist vergrößert und stumpfrandig. Sie weist ein homogenes Echomuster mit erhöhter(mittlerer)
Echogenität auf. Im Parenchym sind nur noch sehr große Gefäße darstellbar. Einegenaue Diagnose
wird durch eine histopathologische Untersuchung einer Feinnadelaspirationoder Biopsie gestellt
(Barr 1992, Gerwing 1993b, Lamb 1995, Selcer 1995, Burk und
Ackermann 1996, Partington und Biller 1996, Nyland et al. 2002b, Peppler et al.
2005).
2.3.5.2 Leberzirrhose
Die zirrhotische, atrophische Leber stellt sich klein dar, die Oberfläche ist unregelmäßig underscheint höckrig. Das Parenchym ist z. T. inhomogen, bedingt durch vermehrte Bindegewebseinlagerungen. Die Portalgefäße sind reduziert und zeigen verminderten Blutfluss. Beifortgeschrittenen Stadien ist ein Aszites vorhanden (Barr 1992, Lamb 1995, Selcer 1995, Burk und Ackermann 1996, Partington und Biller 1996, Nyland et al. 2002b, Peppler et al. 2005).
2.3.5.3
Lebertumoren
Tumoren
in der Leber können als herdförmige oder diffuse Parenchymveränderungenauftreten (Barr 1992). Allein eine Parenchymvergrößerung bei sonst gleichmäßiger Texturkann ein Hinweis auf zellige Tumorinfiltration sein. Dies kommt beim malignen Lymphomvor (Partington und Biller 1996). Eine Sicherung der Verdachtsdiagnose ermöglicht dieLeberbiopsie. Dies gilt auch für die fokalen Lebertumoren (Burk und Ackermann 1996, Partington und Biller 1996, Nyland et al. 2002b). Bei älteren Hunden sind Lebertumorenmeist metastatisch bedingt (Nyland et al. 2002b). Als Primärherd kommen zum BeispielPankreaskarzinom, Mammakarzinom, Fibrosarkom oder Osteosarkom in Betracht.Primärtumoren der Leber sind das hepatozelluläre Adenom bzw. Karzinom und dascholangiozelluläre Adenom bzw. Karzinom. Auch vom Gefäß- oder Lymphsystemausgehende Tumoren kommen in Frage (Nyland et al. 2002b). Eine eindeutigeUnterscheidung erfolgt auch hier intra vitam nur durch eine Biopsie. Das umliegendeLebergewebe weist meist eine unveränderte Echotextur auf (Gerwing 1993b, Lamb 1995, Selcer 1995, Burk und Ackermann 1996, Partington und Biller 1996, Poulsen Nautrup 2001,
Nyland et al. 2002b, Peppler et al.
2005).
2.3.5.4 Leberzysten
Leberzysten können angeboren oder erworben sein, treten singulär oder multipel auf. Zystenhaben eine dünne Wand, echolosen oder echoarmen Inhalt und eine distale Schallverstärkung.Je nach Anzahl und Größe sind sie symptomlos oder können für Enzymerhöhungen undLeberfunktionsstörungen verantwortlich sein. Zystische Veränderungen der Gallengängemüssen von Leberzysten abgegrenzt werden. Eine ultraschallgezielte Punktion von Zysten zurweiterführenden Untersuchung kann abhängig von der klinischen Relevanz sinnvoll sein
(Partington und Biller 1996, Nyland et al. 2002b, Peppler et al.
2005).
2.3.5.5 Leberabszesse
Leberabszesse kommen beim Hund selten vor. Ursächlich liegt meist eine generalisiertebakterielle Infektion zugrunde, perforierende Fremdkörper, kommen ebenfalls als möglicheAuslöser in Betracht. Nach einer Leberlappentorsion oder im Zentrum eines Lebertumorskann es zur Ausbildung von Nekrosen kommen, die sich sonographisch nicht von einemAbszess unterscheiden.
Je nach Flüssigkeitszusammensetzung kann sich das Erscheinungsbild des Abszesses vonecholos bis reflexreich erstrecken. Daher fällt auch die distale Schallverstärkungunterschiedlich deutlich aus. Reflexreiche Stippchen mit schmutzigem Schallschatten inveränderten Leberbezirken sind ein Hinweis auf Beteiligung von gasbildenden Bakterien. Inmanchen Fällen ist das leberumgebende Fettgewebe reflexreich und die regionalenLymphknoten sind vergrößert (Schwarz et al. 1998, Peppler et al. 2005).
Durch ultraschallgezielte Punktion mit einer Spinalkanüle kann direkt diagnostisch
undtherapeutisch eingegriffen werden. Das Punktat wird bakteriologisch und
zytologischuntersucht, Entleerung und Spülung des Abszesses sind möglich (Barr 1992, Gerwing 1993b,
Lamb 1995, Selcer 1995, Burk und Ackermann 1996, Farrar et al. 1996, Partington und
Biller 1996, Nyland et al. 2002b, Peppler et al. 2005).
2.3.5.6 Leberverkalkungen
Bei Verkalkungsherden in der Leber handelt es sich meist um dystrophische Verkalkungen.Als mögliche Ursachen kommen Hämatome, Parasitengranulome oder verheilteLeberabszesse in Frage. Diese Veränderungen treten hauptsächlich bei älteren Hunden auf.Die Größe variiert zwischen einigen Millimetern und einigen Zentimetern. Das umliegende Lebergewebe weist eine physiologische Echotextur auf (Gerwing 1993b, Rettenmaier und Seitz 1994, Hittmair 1997, Peppler et al. 2005).
2.3.5.7 Stauungsleber
Die Stauung der Leber zeigt sich in erster Linie in einer Organvergrößerung mit abgerundetenRändern. Bei der akuten Form zeigt das Leberparenchym eine verminderte Dichte, währendes bei einem chronischen Geschehen grobkörnig wirkt. Das Lumen der Lebervenen isterweitert. Bei der chronischen Stauung fällt eine reflexreiche und verdickte Uferbefestigungdes Pfortaderbaumes durch die vermehrte Bindegewebseinlagerung auf (Gerwing 1993b, Schuler und Börner 2001, Peppler et al. 2005).
2.3.5.8
Hepatitis
Bei akuter Hepatitis ist die Echotextur unverändert, es dominiert eine Organvergrößerung wiebei einer Tumorinfiltration. Im Falle einer chronischen Hepatitis erscheint das Grundgewebeim gesamten Parenchym reflexreich mit multiplen reflexarmen Arealen durchsetzt (Gerwing 1993b, Schuler und Börner 2001).
2.3.5.9 Intrahepatischer
Shunt
Der
Ultraschall als nichtinvasives Diagnostikum steht beim Verdacht eines intrahepatischenShunts an
erster Stelle der zur Verfügung stehenden Untersuchungsverfahren. Durch ihnkönnen rasch
eventuell vorhandene zusätzliche abdominelle Fehlbildungen festgestelltwerden. Zur genaueren
Differenzierung sind dann die mesenteriale Angiographie oderPortographie
notwendig.
Man unterscheidet linke, zentrale und rechte intrahepatische Shunts. Liegt einportosystemischer Shunt vor, ist die Leber auffallend klein, so dass ein mit Gas gefüllterMagen unter Umständen die Sicht auf das Organ von kaudal vollständig verhindert. Beieinem extrahepatischen Shunt sind die Veränderungen des Leberparenchyms analog. Einegenauere Untersuchung und Differenzierung ist mit der Doppler-Sonographie möglich (Gerwing 1993b, Lamb 1998, Nyland et al. 2002b, Peppler et al. 2005).
2.3.6 Dreidimensionale Sonographie der Leber in der Humanmedizin
Der Einsatz des dreidimensionalen Ultraschalls beinhaltet die Bestimmung desOrganvolumens (Hausken et al. 1998) oder vorliegender fokaler Läsionen im Parenchym (Leppek und Klose 1995, Lang et al. 1999). Leberbiopsien können mit Hilfe des 3DProgrammes gezielt entnommen werden (Polaków et al. 2003). Die Volumetrie wird auch zurPlanung und Überwachung der Therapien von Lebertumoren verwendet (Leppek und Klose 1995, Rose et al. 2001). Vor Lebertransplantationen ist die 3D-Untersuchung zur Operationsplanung notwendig (Rose et al. 2001). Im Bereich der Gefäßdiagnostik in der Leber kommtvor allem der dreidimensionale Power Doppler zum Einsatz (Ascenti et al. 2000).
2.3.7 Dreidimensionale Sonographie der Leber beim
Hund
Zur dreidimensionalen Untersuchung der Leber beim Hund liegen bis zum jetzigen Zeitpunktkeine wissenschaftlichen Studien vor. Im Kapitel „Dreidimensionale Sonographie“ imLehrbuch Atlas und Lehrbuch der Ultraschalldiagnostik bei Hund und Katze wird die 3DSonographie der Leber nur angesprochen, aber nicht näher ausgeführt (Poulsen Nautrup 2001).
2.4 2D- und 3D-Volumenbestimmung von
Organveränderungen
Die
zweidimensionale Volumenbestimmung von Organen oder fokalen Veränderungenerfolgt durch die
Messung in zwei senkrecht zueinander stehenden Ebenen. Hier werdenLänge, Breite und Tiefe des
Organs oder des Herdes bestimmt und das Volumen nach derEllipsoidformel V=1/6• 3,14• L• B• T
berechnet (Knauff 1987, Gerwing 1989, Braun 1992a, Braun 1992b, Lang et al. 1999). Die dreidimensionale Volumenbestimmung erfolgt durch3D-Planimetrie und soll die Genauigkeit der Messungen steigern (Gilja et al. 1999). DieGenauigkeit der Methode wurde durch Untersuchungen im Wasserbad mit Benutzung derWasserverdrängung untersucht (Ließ et al. 1994, Riccabona et al. 1996, Wong et al. 1996; Lang et al. 1999). Zur Evaluierung des Verfahrens in der Humanmedizin wurde die Prostataals Organ verwendet (Elliot et al. 1996, Tong et al. 1998). Eine vergleichende Volumetrie vonRattennieren in vivo und in vitro zeigt, dass die dreidimensionale Volumetrie eine neueMöglichkeit der Volumenbestimmung bei kleinen Haustieren darstellt (Strommen et al. 2004).
2.5 Sonographisch gezielte Leberbiopsie als weiterführende Diagnostik
Bei diffusen und fokalen Leberveränderungen sind für eine weiterführende DiagnostikProbenentnahmen notwendig. Mit Hilfe des Ultraschalls ist es möglich, eine gezielteperkutane Biopsie oder Aspiration durchzuführen. Vor diesen Eingriffen muss derGerinnungsstatus überprüft werden. Bei ruhigen Patienten kann eine Punktion wach erfolgen.Um Komplikationen durch Abwehrbewegungen zu vermeiden, werden Biopsien der Leber inNarkose durchgeführt. Zur exakten Nadelführung kann eine Biopsiehilfe am Schallkopfbefestigt werden. Mit deren Hilfe ist es möglich Herde von wenigen Millimetern sicher zupunktieren. Die entnommenen Proben werden zytologisch oder histologisch untersucht(Partington und Biller 1996, Selcer 1995, De Rycke et al. 1999, Schuler und Böhner 2001, Nyland et al. 2002a, Wang et al. 2004, Peppler et al. 2005).
3 Eigene Untersuchungen
3.1 Gerätebeschreibung, Verarbeitungsmethoden
Die
Ultraschalluntersuchungen für diese Arbeit wurden mit dem Gerät LOGIQ 9 der FirmaGeneral
Electric (GE) durchgeführt. Je nach Größe des Tieres kommen der KonvexschallkopfM7C mit einem
Frequenzbereich von 4 bis 7 MHz oder der Linearschallkopf M12L miteinem Frequenzbereich von 9
bis 12 MHz zum Einsatz.
Die Erhebung der Rohdatensätze erfolgte mit dem Tru 3D Programm. Hierbei wird währendder Bilderstellung ein Sensor eingesetzt. Dieser ermöglicht die exakte Volumenbestimmungvon Organveränderungen. Für diese dreidimensionalen Aufnahmen werden derelektromagnetischer Sensor, der dazugehöriger Magnet und das Scan-Braket zur Befestigungdes Sensors am Schallkopf verwendet. Der Hersteller des Gerätes weist in derBedienungsanleitung darauf hin, dass sich der Patient während der Erfassung der Rohdatennicht bewegen darf.
Die Bildrekonstruktion erfolgte mit dem Bearbeitungsprogramm LOGIQworks der Firma
GE.Mit Hilfe des TruAccess Raw Data Processing besteht die Möglichkeit der Verarbeitung von2D- und 3D-Datensätzen. Mit der Funktionstaste „Caliper“ kann eine nachträgliche Messungim zweidimensionalen Datensatz durchgeführt werden. Zweidimensionale Bilder werdenzusätzlich mit einer digitalen Bilddokumentation (Sonowin®)1
erfasst.
Für den dreidimensionalen Datensatz sind mehrere verschiedene Verarbeitungsmethodenmöglich. Zunächst erfolgt die 3D-Darstellung im Würfelmodell, in dem per Mausklick dieeinzelnen Ebenen verschoben und dargestellt werden können. Zusätzlich enthält dasProgramm die Möglichkeit einer Movie-Präsentation. Ähnlich einem MRT- oder CTVerfahren besteht die Option alle drei Ebenen als Schnittbilder oder als Ebenen
mit mehrerenSchnitten zu projizieren.
Für die Volumetrie stehen in diesem Programm zwei Möglichkeiten zur Auswahl. Die Angular-Methode errechnet das Volumen anhand von 6 im unterschiedlichen Winkelzueinander stehenden Flächen. Die Serial-Methode ermöglicht durch Umfahren der Fläche inbeliebiger Häufigkeit eine exakte Volumetrie bei unförmigen Gebilden.
3.2 Patientengut
Für die durchgeführten Untersuchungen wurden Patienten der Klinik für Kleintiere,Chirurgie, der Justus-Liebig-Universität Gießen verwendet. Indikationen zur Sonographie derLeber waren gestörtes Allgemeinbefinden, unklare Palpationsbefunde, radiologischeVeränderungen oder Leberwertabweichungen in der blutchemischen Untersuchung.Zusätzlich wurden Patienten in dieser Arbeit berücksichtigt, die aufgrund andererFragenstellungen sonographisch untersucht wurden und bei denen Leberveränderungen alsZufallsbefund vorlagen. Insgesamt wurden 49 Patienten ausgewertet. Das Alter der Tiere lagzwischen 2 und 15 Jahren, bei einem Durchschnitt von 10,24 Jahren. DieGeschlechtsverteilung ergab 27 männliche und 22 weibliche Tiere. Die Rassenhäufigkeit istder folgenden Tabelle zu entnehmen (Tabelle 1).

Bei den Patienten wurden multiple Herdveränderungen, wie z. B. Tumoren (n=37), Zysten(n=5), Verkalkungen (n=2) festgestellt. Bei 4 Patienten wies die Leber eine hochgradigeInhomo-genität auf. Zusätzlich wurde ein Patient mit Gallenblasenveränderungen untersucht.Bei 24 Patienten wurden während der Untersuchung ultraschallgezielte Proben ausveränderten Bezirken entnommen und zur zytologischen oder pathologisch-histologischenUntersuchung geschickt.
In der
Tabelle 2 sind alle Patientendaten zusammengefasst.




3.3 Vorbereitung der Patienten
3.3.1 Lagerung
Zur Anfertigung des zweidimensionalen Ultraschalls und des 3D-Scans wurden die Tiere inRückenlage verbracht. Die Untersuchung erfolgte auf einem Tisch mit Holzplatte undMetallbeinen. Um die Rückenlage zu erleichtern lagen die Patienten auf einem mitStyroporkügelchen gefüllten Lagerungskissen. Bei narkotisierten Patienten wurde zurbesseren Lagerung eine Liegeschale verwenden. Die Ausrichtung des Patienten erfolgteparallel zum Gerät. Alle Patienten waren zum Zeitpunkt der Untersuchung mindestens 12Stunden nüchtern.
3.3.2 Ankopplung
Zur Reduktion von Artefakten wurden die Patienten ventral vom Inguinalbereich bis zumRippenbogen auf 1/10 mm Haarlänge geschoren. Die Ankopplung erfolgte mithandelsüblichem Sonographiegel (Sonogel®)2.
3.3.3
Anästhesie
Bei 14
der 49 Patienten (28,6 %) wurde die dreidimensionale Untersuchung in Narkosedurchgeführt. Nach
Legen eines venösen Zuganges erfolgte die Prämedikation mit 0,5-1mg/kg KGW Valium3 und
0,02-0,05 mg/kg KGW Atropin4. Die Narkose wurde mit 3 mg/kgKGW Ketamin5 und 0,3
mg/kg KGW Xylazin6 erhalten.
3.4 Untersuchungsgang
3.4.1 Zweidimensionale Untersuchung
Am vorbereiteten Patienten erfolgt die Platzierung des Schallkopfes kaudal des Processusxiphoideus. Der Scanner wird gekippt mit kaudo-kranialer Schallrichtung. DasLeberparenchym wird sowohl in Längs- als auch in Querrichtung komplett durchgemustert.Fokale Leberherde werden im Bild in ihrer größten Ausdehnung in diesen zwei Schnittebenendokumentiert. Die anschließende Messung dieser Rundherde in drei Ebenen dient derVolumetrie.Die zweidimensionale Untersuchung geschieht an wachen Patienten. Bei 16 von 49 Patienten(32,6 %) wurde die 2D-Sonographie in Narkose wiederholt.
3.4.2 Dreidimensionale
Untersuchung
Für die
dreidimensionale Untersuchung wird am verwendeten Schallkopf derelektromagnetische Sensor mit
Hilfe eines Scan-Brackets befestigt. Der Magnet muss aufHöhe des zu untersuchenden Organs
aufgestellt werden (Abbildung 1).

Die Software des Ultraschallgerätes wird auf den 3D-Modus umgeschaltet. Daraufhinerscheint im Touchscreen die Auswahlmöglichkeit „mit“ oder „ohne“ Sensor. NachBestätigung der Sensornutzung erscheint auf dem Monitor ein zweigeteiltes Bild. Links ist derBildausschnitt des Schallkopfes zu sehen. Nach Drücken der Starttaste wird dieOrganveränderung auf den Magneten zu gescannt. Dabei erscheint im rechten Bildausschnittmit blauen Linien gezeichnet die Anzahl der Schnittbilder. Nach Drücken der Stopptaste wirdder Untersuchungsgang beendet. Es erfolgt eine direkte Berechnung der erfassten Rohdaten,die dann im Würfelmodell erscheinen (Abbildung 2).

Bei drei der 49 Tiere (6,1 %) wurden 3D-Datensätze nach Euthanasie angefertigt. Die Patienten
wurden aufgrund schlechten Allgemeinbefindens euthanasiert. Die Untersuchung dieserTiere
erfolgte zu Beginn der Studie, um den Einfluss des Untersuchers auf die Qualität derRohdatensätze besser beurteilen zu können. Neun von 49 Patienten (18,4 %) standen ausschließlich in Narkose
für die Untersuchung zu Verfügung. Die Erstellung der 3D-Rohdatenkonnte bei 34 der 49 Patienten
(69,4 %) ohne Narkose durchgeführt werden, wobei ein Tier (US Nr.
24332) zweimal wach untersucht wurde. Bei 3 Patienten (6,1 %) wurden sowohl mitals auch ohne
Narkose 3D-Bilder erstellt.Die Anzahl der erhobenen Rohdatensätze hing von der Kooperation des
Patienten und demsubjektiven Eindruck ab, ob der Datensatz auswertbar war. Pro Patient schwankte
die Anzahlder Untersuchungen zwischen einem und 10 angefertigter Rohdatensätze. Insgesamt
lagen194 Datensätze zur weiteren Bearbeitung vor. Durchschnittlich wurden pro Patient
3,7Rohdaten erhoben. Die Zusammenfassung dieser Daten ist in Tabelle 3 ersichtlich.




3.4.3 Bildbearbeitung
3.4.3.1 Artefakte
Nach
Erstellung der Rohdaten erfolgt die Bildbearbeitung. Diese kann sowohl amUltraschallgerät LOGIQ
9 als auch mit dem externen LOGIQworks Programm erfolgen. AmLOGIQ 9 ist bei Erstellung der Daten
das 3D-Programm automatisch aktiviert.
Die weitere Bildbearbeitung hängt von der Qualität der angefertigten Rohdatensätze ab.
Dieunterschiedliche Ausprägung von Artefakten als Folge von Bewegungen (durch den
Patientenoder den Untersucher) haben erheblichen Einfluss auf die weiteren
Bearbeitungsmöglichkeiten. Diese Bewegungsartefakte verursachen Bildunschärfe oder reflexarmeQuerstreifen, die keine ausreichende Bildinformation beinhalten (Abbildung 3). AuchArtefakte, die bereits im 2D-Bild vorhanden sind, wie z. B. bei Gas (Abbildung 4) oderdistalem Schallschatten unter Verkalkungen, können eine weitere Bearbeitung erschwerenoder unmöglich machen.


Die Artefaktausprägungen der 194 Rohdatensätze wurden in 6 Artefaktstufen eingeteilt.
DieAbstufungen und Kriterien dieser Einteilung sind in Tabelle 4 aufgelistet.

In der Auswertung lassen sich 8,6 % der Rohdatensätze (n=17) der Stufe 1 zuordnen. 10,7
%der Datensätze (n=21) werden in die Stufe 2 eingeordnet und 31,5 % der Rohdaten (n=62)
indie 3. Stufe. 26,4 % der Daten (n=52) zeigten mittelgradige Artefakte, womit sie Stufe
4zugeordnet werden. In Stufe 5 mussten 11,8 % (n=23) und in der 6. Stufe 9,6 % derRohdatensätze (n=19) eingeordnet werden. Die Ergebnisse sind im Diagramm 1 zusammengefasst.

Drei Tiere wurden nach Euthanasie untersucht. Dabei wurden 14 Rohdatensätze
erstellt.Mittel-hochgradige sowie hochgradige Artefakte konnten nicht festgestellt werden.
Beijeweils 7,2 % der Datensätze waren keine bzw. mittelgradige Artefakte erkennbar (jeweils
einDatensatz). Geringgradige Artefakte traten bei 28,6 % der Datensätzen (n=4) und
geringmittelgradige Artefakte bei 57 % der Datensätzen (n=8) auf. Da die Anzahl der Datensätze beieuthanasierten Tieren vergleichsweise gering ist, sind diese in einem gesonderten Diagramm2 aufgeführt.

An 35 wachen Patienten wurden 68,5 % der Rohdatensätze (n=133) erhoben, davon
zeigten8,3 % (n=11) keine und 12 % (n=16) geringgradige Artefakte. 24,1 % der Datensätze
(n=32)wurden in Stufe 3 und 24,8 % (n=33) in Stufe 4 eingeordnet. Bei 16,5 % der Rohdaten
(n=22)erfolgt die Einordnung in Stufe 5, bei 14,3 % der Rohdaten (n=19) in Stufe 6.
An 13 narkotisierten Tieren wurden 24,2 % der Rohdaten (n=47) aufgenommen. 10,6 %
vondiesen Daten (n=5) wiesen keine Artefakte auf, während 2,1 % der Datensätze (n=1) in
Stufe2 eingeordnet werden konnten. Bei 46,8 % der Daten (n=22) konnten
gering-mittelgradigeArtefakte, bei 38,3 % (n=18) mittelgradige Artefakte und bei 2,1 % der
Datensätze (n=1)mittel-hochgradige Artefakte festgestellt werden. Kein Rohdatensatz konnte in
Stufe 6eingeordnet werden.
Eine Gegenüberstellung der Artefaktausprägungen am wachen und am narkotisierten Tier
istim Diagramm 3 aufgeführt.

3.4.3.2 Darstellung verschiedener Ebenen
Mit Hilfe des Trackballs kann der Rohdatenwürfel beliebig gedreht werden. Ebenso könnenalle Ebenen bis zum Erreichen der Veränderung verschoben werden. Zusätzlich lassen sichdie Winkel der Ebenen den Veränderungen anpassen, wie auch die Winkel der Senkrechten.In den Abbildungen 8 und 9 erkennt man die Einstellung der einzelnen Ebenen imWürfelmodell. Die rot gekennzeichnete Ebene ist die zuletzt modifizierte. Damit könnenbereits sehr genaue Informationen über die vorliegende Veränderung, in diesem Fall eineLeberzyste (US Nr. 20801), erfasst werden. Abbildung 5 zeigt die Verschiebung in dercoronaren Ebene.
Bei Verschiebung der sagittalen Ebene zeigt sich der dreidimensionale Effekt des
Würfelsund bietet die Möglichkeit, alle Ebenen der Veränderung einzusehen. Die Verschiebung
dersagittalen Ebene ist in Abbildung 6 am Beispiel einer Zyste (US Nr. 20801)
veranschaulicht.


Abbildung 7 zeigt diesen Effekt am Beispiel einer gewebigen Zubildung (US Nr. 25163).

Durch die Taste Tile können bis zu 6 Würfel nebeneinander dargestellt werden. So ergibt sichdie Möglichkeit mehrere Ebenen im Würfel gleichzeitig zu verändern (Abbildung 8). Indiesem Fall wurde ebenfalls das Beispiel eines Lebertumors (US Nr. 23181) gewählt.Mit Hilfe des Feldes Group Plane sind mehrere Wahlmöglichkeiten gegeben. Im OFF Statuserscheint das normale Würfelmodell. Beim Wählen des Status MAIN werden die drei Ebenenim 90° Winkel zueinander abgebildet. Diese Ebenen können beliebig gegeneinanderverschoben werden. Eine Untersuchung der bis dahin nicht darstellbaren coronaren Ebene isthier im Vergleich zur sagittalen und transversalen Ebene möglich. Am Beispiel derLeberzyste (US Nr. 20801) kann man die unregelmäßige Begrenzung sehr gut erkennen(Abbildung 9).
Auch bei
gewebigen Veränderungen (US Nr. 23535) gibt diese Darstellungsform weiterenAufschluss (Abbildung
10).

Zur besseren Veranschaulichung wurde das Orginalbild in vier Einzelbilder aufgeteilt.
DieOriginale der Abbildungen 8, 9 und 10 sind im Anhang als Abbildung A, B und C
einsehbar.




Durch Anwählen des Status PARALLEL werden bis zu 6 Schnittbilder ähnlich einer CT-
oderMRT Darstellung produziert. Durch Anwählen des Graubildes auf die gewünschte
Positionim ersten und letzten Würfel ergibt sich der Millimeterabstand der einzelnen
Schnittbilderzueinander (Abbildung 11). Der aktuelle Abstand der einzelnen Bilder ist am Monitor
ersichtlich.

Die Bildbearbeitung im Würfelmodell setzt voraus, dass nur maximal mittelgradige
Artefakteim Rohdatensatz enthalten sind. In manchen Fällen fallen Bewegungsartefakte erst
beim Durchfahren im Würfel auf. Nach einer solchen Bildbearbeitung ist zu
entscheiden, ob eineweitere Auswertung im Renderingprogramm oder eine Volumetrie durchgeführt
werden kann.
3.4.3.3 Volume Rendering (Transparente Darstellung)
Durch Wahl des Modus Render fällt die Würfelstruktur zur räumlichen Darstellung weg. Eserscheint der Organabschnitt in unterschiedlichen Graustufen, so dass ebenfalls eindreidimensionaler Eindruck entsteht. Im Tru 3D-Programm kann man diese Graustufen aufmehrere Arten variieren. Es besteht die Möglichkeit zwei verschiedene Typen von Graustufenanzuwählen. Beide Graustufen-Arten enthalten nahezu die gleichen Einstellungstypen. Typ 1bietet die Wahl von 6 verschiedenen Einstellungsvarianten, während Typ 2 die Wahl von 5Varianten ermöglicht. Auf diese Art sind eine Reihe von Kombinationen bei denEinstellungen möglich (Diagramm 4).

Die Grey Surface ist eine dieser Einstellungsmöglichkeiten, um eine transparente
Darstellungdes Objektes zu erreichen. Die Texture Einstellung ist ähnlich einer Fotografie.
Maximumund Minimum Intensity stellen den höchsten bzw. den niedrigsten Grauwert des Objektes dar.Die Average Intensity ist eine Summation der Graustufen. Die letzte Variante im Typ 2 ist dieEinstellung ohne Typ 2, so dass auch eine Darstellung ohne Kombination möglich ist. BeideTypen können mit den Reglern Threshold/Opacity in ihrer Graustufenqualität gesonderteingestellt werden. Durch Veränderung des Schwellenwertes werden die erkannten Graustufen verstärkt oder
abgeschwächt. Mit dieser Nachbearbeitung können dieunterschiedlichsten Strukturen ihrer
Bedeutung entsprechend hervorgehoben oderabgeschwächt werden. Auf den Abbildungen 12 bis 15 sind
die unterschiedlichenKombinationen von Texture und Grey Surface dargestellt.




Unterschiedliche Kombinationen von Grey Surface und Texture haben großen Einfluss
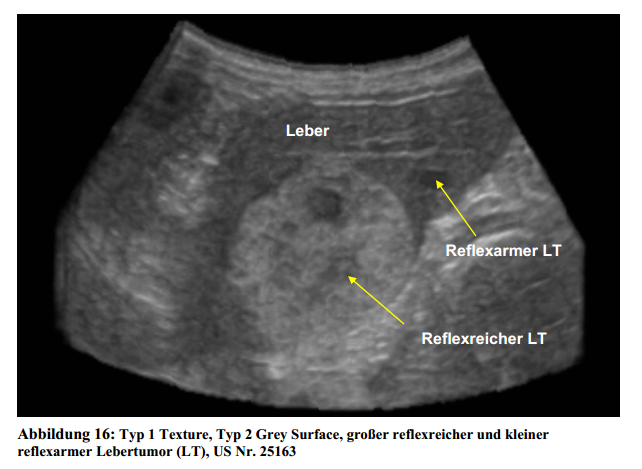
aufdie Auswertbarkeit von im Bild enthaltenen Informationen. Der Patient mit der US Nr.
25163zeigt mehrere rundliche Zubildungen im Leberparenchym. Neben einem größerenreflexreichen und inhomogenen Rundherd ist ein kleiner reflexarmer Rundherd darstellbar.Bei der Wahl beider Funktionen sind beide fokalen Herde im Parenchym erkennbar(Abbildung 16 bis18)

Besetzt man nur die erste Variante (Typ 1), in diesem Fall mit Grey Surface, können
Informationen verloren gehen. Der reflexarme Rundherd ist kaum erkennbar.

Durch die Funktionstaste Tile besteht auch mit der Render-Funktion die Möglichkeit, eingerendertes Bild einem normalen Würfel gegenüber zu stellen. Dadurch wird im RenderingProgramm der dreidimensionale Eindruck mit dem im Würfel vergleichbar. Abbildung 19zeigt dies am Beispiel der Leberzyste, US Nr. 20801.

In der Abbildung 20 ist dies mit einem Lebertumor aufgezeigt.

Analog zu den Artefakten wurden alle Rohdatensätze nach ihrer Auswertbarkeit undBearbeitungsqualität eingeteilt und einer Skala von 1-6 zugeordnet. Die Kriterien dereinzelnen Stufen sind in Tabelle 4 aufgeführt.

Das Diagramm 5 enthält die Auswertung der Bearbeitungsqualität aller erfassten
Rohdaten.

Von den insgesamt 197 Rohdaten zeigten 9,6 % (n=19) eine sehr gute
Bildbearbeitungsqualität. 14,2 % der Daten (n=28) waren gut, 28,4 % (n=56) waren befriedigend in der Bildbearbeitung. Eine ausreichende Qualität konnte bei 23,3 % der Rohdaten (n=46)
festgestelltwerden. Mangelhafte Bearbeitung wiesen 12,2 % Daten (n=24) auf, 10,7 % (n=21)
sogarungenügende. Die Unterteilung der Untersuchungen am toten Tier (n=14) (Diagramm 6),
amwachen Patienten (n=133) und am narkotisierten Patienten (n=47) (Diagramm 7) wurde
wiebei der Überprüfung der Artefakte durchgeführt. Bei den drei toten Tieren wurden
keineungenügenden sowie mangelhaften Daten erstellt. 3 Datensätze zeigten eine ausreichende,
6eine befriedigende und 4 eine gute Bearbeitung. Lediglich ein Datensatz konnte sehr
gutweiter bearbeitet werden. Da die Anzahl der Datensätze bei euthanasierten Tieren
vergleichsweise gering ist, sind diese in einem gesonderten Diagramm aufgeführt (Diagramm 6).

Bei den wachen Patienten zeigte sich bei 9,8 % der Daten (n=13) eine sehr gute
Bildqualität,bei 15 % (n=20) noch eine gute Qualität. Eine befriedigende Bearbeitung konnte bei
24,8 %der Rohdaten (n=33) durchgeführt werden, hingegen war in 19,5 % der Fälle (n=26) nur
eineausreichende Bearbeitung möglich. Mangelhafte bzw. ungenügende Bearbeitung ergab
sichbei 15 % (n=20) bzw. 15,8 % (n=21) der Rohdaten.

In Narkose waren 10,6 % der Daten (n=5) sehr gut in der weiteren Bearbeitung und 8,5 %(n=4) gut. Befriedigende bzw. ausreichende Qualität zeigten jeweils 36,8 % der Rohdaten(n=17). In 8,5 % der Fälle (n=4) konnten die Datensätzen nur mangelhaft weiterbearbeitetwerden. Es wurden keine ungenügenden Rohdaten erstellt. Die Ergebnisse sind imvorangegangen Diagramm 7 aufgeführt.
3.4.3.4 Volumetrie
Das
Programm bietet zwei verschiedene Methoden zur Volumetrie an. Mit der AngularMethode
erstellt das Programm nach Legen einer definierten Achse 6 Ebenen, die zurMessung herangezogen werden. Die zweite Möglichkeit ist die Serial-Methode. Dabeiwerden Flächen in unterschiedlichen Tiefen der Veränderung eingezeichnet und daraus wirddas Volumen bestimmt. Auf dem Monitor sind ein Würfelmodell und eine 2D Projektionnebeneinander abgebildet. Auf der linken Seite werden in der Ebene die zu berechnendenFlächen eingezeichnet. Rechts steht gleichzeitig ein Würfelmodell, in dem die einzelnenEbenen verschoben werden können, so dass hier die Einstellung der Tiefe erfolgt (Abbildung21). Je mehr Flächen umfahren werden und zur Volumenbestimmung zur Verfügung stehen,desto exakter wird diese. Zur Überprüfung erscheint im linken Bildausschnitt ein Quadrat, indem die erfassten Werte aufgeführt sind. AREA gibt die Fläche des umfahrenen Areals an.POSITION zeigt an, in welcher Tiefe das umfahrene Areal liegt. VOLUME errechnet dasaktuelle Volumen. Während der Messung ist die Linie der aktuell gekennzeichneten Flächerosa, die bereits markierten Flächen erscheinen grün.

Der Vergleich der Volumina erfolgte in dieser Arbeit mit Anwendung der Serial-Methode,da durch die Markierung beliebig vieler Flächen das Volumen exakter berechnet werdenkann. Bei unregelmäßigen Veränderungen besteht ein weiterer Vorteil durch dieeigenständige Umfahrung des Umrisses, so dass auch hier eine exaktere Berechnung möglichist.
Im True Access Modus können mit der Taste Caliper am zweidimensionalen Bildnachträglich Messungen mit Hilfe des LOGIQworks Programmes vorgenommen werden.
3.4.3.5 Vergleich der 2D-Messung und der
Volumetrie
Von den
49 Patienten und insgesamt 194 erfassten Rohdatensätzen standen 24 Patienten(49 %) mit 94
Rohdaten (48 %) zur Volumetrie zur Verfügung. Bei 25 Patienten (51 %) mit100 Rohdatensätzen (52
%) war keine Volumetrie möglich. Bei 4 Tieren (16 %) wurden bei17 Rohdatensätzen (17 %) die
3D-Untersuchungen ohne Sensor durchgeführt. Die Voraussetzung für eine Volumetrie ist eine fokale Veränderung im Organ. Dies war bei 9 der 25Patienten (36 %) und 37 Rohdatensätzen (37 %) nicht der Fall. Bei 6 der 25 Tiere (24 %) mit23 Rohdaten (23 %) konnte durch zu starke Bewegungen oder zu große Zubildungen keinausreichender Scan angefertigt werden. Hochgradige Artefakte im Scan machten eineAbgrenzung des fokalen Herdes zum umliegenden Gewebe bei 6 Tieren (24 %) mit 23Rohdaten (23 %) unmöglich. Die prozentuale Auswertung dieser nicht zur Volumetriegeeigneten Rohdaten ist Diagramm 8 zu entnehmen.

Bei 24 von 49 Patienten (49 %) erfolgte eine Volumenmessung. Dazu wurde der Rohdatensatz mit den
wenigsten Artefakten ausgewählt und die Messung nach der Serial-Methodeangefertigt. Der Patient
mit der US Nr. 25421 zeigte mehrere Rundherde im Leberparenchym.
Hier wurden zwei verschiedene Veränderungen mit beiden Methoden gemessen. Diezweidimensionale Volumenbestimmung erfolgte bei allen Patienten nach der Ellipsoidformel.Länge, Breite und Tiefe wurden mit dem LOGIQworks Programm vermessen. Alle 2D- und3D-Messungen wurden dreimal an einem Scan ausgeführt und daraus das arithmetische Mittelgebildet, um die Intrauntersuchervariabilität zu gewährleisten. Eine Interuntersuchervariabilität durch zwei
unabhängige Untersucher konnte nicht durchgeführt werden. In denTabellen 5 und 6 sind die
Ergebnisse der beiden Untersuchungen aufgeführt.Zusätzlich zur Volumetrie wurden die
vorliegenden Veränderungen im Parenchym nach ihrenFormen in drei Kategorien eingeteilt.
Kategorie 1 beinhaltet alle Veränderungen, bei deneneine ellipsoide Form vorlag (Abbildung
22).Dreizehn der 24 Parenchymveränderungen (54,2 %) wurden in die Kategorie 1
eingeordnet.

In Kategorie 2 fielen die Parenchymveränderungen, die geringe Abweichungen vom
Ellipsoidzeigten (Abbildung 23). Hier wurden 6 der 24 Veränderungen (25 %) zugeordnet.
FokaleHerde mit amorphen Umrissen gehörten zur Kategorie 3 (Abbildung 24). Diese Form
konntebei 5 der 24 Leberveränderungen (20,8 %) festgestellt werden.


In Tabelle 5 sind Form und Messergebnisse nach der Ellipsoidformel zusammengefasst.Tabelle 6 enthält die Ergebnisse der dreidimensionalen Volumetrie.


Die Berechnungsergebnisse mit der Ellipsoidformel lagen zwischen 0,12 ml und 129,29
mlbei den Einzelmessungen und zwischen 0,13 ml und 126,81 ml bei den
Durchschnittswerten.Im 3D-Programm konnte in der Einzelmessung ein Minimalwert von 0,16 ml und
einMaximalwert von 165,93 ml festgestellt werden. Bei den Durchschnittswerten lag die
Spannezwischen 0,19 ml und 157,85 ml. Eine genaue Gegenüberstellung der
Messergebnissebefindet sich im Anhang (Tabelle J). Von den 2D-Untersuchungen waren 20 der 24
Durchschnittsvolumina (83,3 %) im Bereich bis 50 ml, 2 der 24 Durchschnittswerte (8,3 %) lagenzwischen 50 und 100 ml und 2 der 24 Messungen (8,3 %) über 100 ml. Im Rahmen der 3DVolumetrie sind 18 der 24
Volumina (75 %) im Bereich bis 50 ml. Drei der 24 Messungen(12,5 %) hatten Werte zwischen 50 und
100 ml und 3 der 24 Messungen (12,5 %) über100 ml. Die Volumenverteilung ist in Diagramm 9
zusammengefasst.

3.4.3 Durchführungsdauer der 3D-Untersuchung
Bei 10 zufällig ausgewählten Patienten mit sehr guten bis befriedigenden Datensätzen wurdedie Zeit gemessen, die zur kompletten Nachbearbeitung des Patienten, inklusive Volumetrie,notwendig war. Die Ergebnisse sind in Tabelle 7 aufgeführt.

Es ergibt sich eine durchschnittliche Nachbearbeitungszeit von 8,2 Minuten, mit
einemMinimum von 5 Minuten und einem Maximalwert von 13 Minuten. Die
Anfertigungsdauereines Rohdatensatzes dauert ca. 4,5-5 Sekunden, die Berechnung des Datensatzes
ca. 25-30Sekunden.
3.4.4 Lage der Läsion im Parenchym
Die Leberveränderungen wurden bei allen 49 Patienten auf ihre Lage hin untersucht, umEinflüsse auf eine weitere Bearbeitung festzustellen. Eine eindeutige Zuordnung der Leberlappen ist ohne
Hydroperitoneum nicht möglich, so dass nur eine Einteilung nach links- oderrechtsseitiger Lage
im Parenchym vorgenommen wurde. Lagen multiple, lokalisierteLäsionen im Leberparenchym
gleichmäßig verteilt vor, wurde es als „gesamte Leberbetroffen“ behandelt. Zusätzlich wurde
beurteilt, ob die Lage der Veränderung als zentral,randständig oder zwerchfellnah einzuordnen
war. Waren hier die Läsionen multifokal verteilt(gesamter Leberbereich betroffen), wurde
beurteilt, in welchem Bereich die Mehrheit derLäsionen zu finden waren. Randständige Zubildungen
konnten über die Leberoberflächehinaus nachvollzogen werden. Die Abbildungen 25, 26 und 27
zeigen Beispiele für diegefundenen Läsionen.



In der nachfolgenden Tabelle 8 sind die Lage der Veränderung, die Ergebnisse produrchgeführter Untersuchung für Artefakte und Bildbearbeitungsqualität sowie dieMöglichkeit zur Volumetrie zusammengefasst.




Bei 53,1 % der 49 Patienten (n=26) konnten die Leberläsionen der linken Leber, bei 30,6
%der 49 Patienten (n=15) der rechten Leber zugeordnet werden. Die gesamte Leber war
bei16,3 % der 49 Patienten (n=8) betroffen. Diese Verteilung wird im folgenden Diagramm
10dargestellt.

Während der weiteren Untersuchung der 49 Patienten auf die exakte Lage der Läsionen
imrechten bzw. linken Parenchymbereich zeigten sich 23 der 49 Läsionen (46,9 %)
zentrallokalisiert. Davon waren 5 (21,7 %) rechtsseitig, 13 (56,6 %) linksseitig, 5 (21,7 %)
über dengesamten Leberbereich verteilt. Die Grafik ist in Diagramm 11 aufgeführt.

Bei 17 von 49 Leberläsionen (34,7 %) konnte eine randständige Zubildung festgestellt werden.
Davon waren 10 (58,8 %) linksseitig und 7 (41,2 %) rechtsseitig. Randständige Veränderungen, die die gesamte Leber betrafen, traten nicht auf. Diese Verteilung ist in Diagramm12 aufgeführt.

Eine zwerchfellnahe Läsion wurde bei 6 der 49 Veränderungen (12,2 %) ermittelt,
wovonjeweils 3 linksseitig (50 %) und 3 rechtsseitig (50 %) waren. Auch hier waren keine
multiplenVeränderungen im Bereich den gesamten Leberbereich erkennbar. Diese Auswertung ist
inDiagramm 13 aufgeführt. Bei 3 der 49 Leberveränderungen (6,1 %) konnte keine
Lokalisationfestgelegt werden, hier handelte es sich um inhomogene Alterationen der Patienten
16116,22497 und 23534.

3.4.5 Entnahme von Leberbiopsien
Die untersuchten Patienten wiesen verschiedenste Veränderungen der Leber auf, wie z. B.Tumoren (n=37), Zysten (n=5) und Verkalkungen (n=2). Bei 4 Patienten zeigte das Leberparenchym eine
hochgradige Inhomogenität. Zusätzlich wurde ein Patient mit Gallenblasenveränderungen untersucht (Diagramm 14).Bei 24 der 49 Patienten (49%) wurden während der Untersuchung ultraschallgezielte Proben(Punktion oder Biopsie) aus veränderten Bezirken entnommen und zur zytologischen oderpathologisch-histologischen Untersuchung geschickt.

Die Leberpunktion zur zytologischen Untersuchung konnte immer am wachen Patientendurchgeführt werden. Alle Biopsien zur pathologisch-histologischen Untersuchung wurden inNarkose entnommen. Insgesamt konnten 11 tumoröse, 6 degenerative und 4 entzündlicheVeränderungen diagnostiziert werden. In einer Probe zeigte das Lebergewebe vermehrteErythropoese, einmal waren die entnommen Gewebeanteile nicht auswertbar. Eine genaueAufstellung der aufgetretenen Erkrankungen gibt das folgende Diagramm 15 wieder.Vom sonographischen Bild war sowohl in der zweidimensionalen als auch in derdreidimensionalen Untersuchung keine Differenzierung möglich. Die Probenentnahme zurweiterführenden Untersuchung ist zur Diagnosesicherung unerlässlich.

Die Auswertung erfolgte in den Kategorien Artefakte, Bildbearbeitung und Volumetrie.
DiePatienten wurden dafür in drei Gruppen eingeteilt: wache Patienten, narkotisierte
Patientenund euthanasierte Tiere. Pro Patient erfolgten zum Teil mehrere
Untersuchungennacheinander. Im weiteren Verlauf der Auswertung werden die Worte Messung
undAnfertigen eines Rohdatensatzes als Synonyme verwendet. Die Zusammenfassungen derDatensätze nach Artefaktausprägung und Bearbeitungsqualität sind in den Tabellen 9 und 10enthalten.

Die genaue Aufschlüsselung der einzelnen Daten ist in den Tabellen A-H im Anhang zuersehen.
3.5.1 Artefakte, Bildbearbeitung
Der folgende Abschnitt behandelt die Fragestellung, inwiefern der Status des Patienten (wach,narkotisiert oder euthanasiert) die Artefaktausprägung und Bildbearbeitung bei Anfertigungder Rohdatensätze beeinflusst.
Beim Patient Nr. 24332 wurden 4 Messungen an Zubildung 1 und eine Messung anZubildung 2 durchgeführt, so dass für die statistische Auswertung diese Daten als 5Messungen einer Zubildung interpretiert wurden.
Es erfolgte eine statistische Auswertung der Rohdaten nach dem Test auf gemustertenGruppeneffekt bei Versuchsanlagen für mehrere Gruppen mit abhängigenMesswiederholungen (Brunner und Langer, 1999) sowohl für die Artefaktausprägung alsauch für die Bildbearbeitung. Die Anwendung des Testes bei der Untersuchung am wachenPatient gegenüber der Untersuchung an bereits euthanasierten Tieren ergibt mit einemp=0,049 (5 % Niveau) einen signifikanten Unterschied. Allerdings ist die Gruppe dereuthanasierten Tiere mit nur 3 Patienten sehr klein, so dass die Aussagekraft nicht sehr hochist. Der große Einfluss des Untersuchers auf die Qualität der Datensätze lässt sich daranerkennen, dass erst beim 3. euthanasierten Patienten (US Nr. 23535) gute Ergebnisse erzieltwerden konnten (Anhang, Tabellen F und J). Bei der Gegenüberstellungen der Untersuchung„wacher Patient / narkotisierter Patient“ konnte mit dem Test für die Ausprägung derArtefakte ein signifikanter Unterschied auf dem 5 % Niveau (p= 0,031) nachgewiesenwerden.
Zusammen mit den Diagrammen aus Kapitel 3.4.3 lässt sich eruieren, dass dieArtefaktausprägung in Narkose deutlich geringer ist, da die mittel-hochgradigen Artefakte inNarkose auszuschließen sind. Dagegen verdeutlichen die Diagramme, dass für die Erstellungartefaktfreier Rohdaten nicht zwangsläufig eine Narkose notwendig ist.
Die Ausprägung der Artefakte entscheidet über die weiteren Bearbeitungsmöglichkeiten
derRohdaten. Da die Werte der Untersuchung nicht normalverteilt waren, musste der
obengenannte Test gewählt werden. Die Auswertung der Qualität der Bildbearbeitung
ergabkeinen signifikanten Unterschied zwischen der Anfertigung beim euthanasierten, wachen
odernarkotisierten Patienten. Möglicherweise ist der Stichprobenumfang für diesen Test zu
klein,so dass die Güte des Testes zu niedrig ist, um einen signifikanten Unterschied zu
erkennen.Die Darstellung verschiedener Ebenen ist prinzipiell durchführbar, allerdings nimmt
beizunehmender Artefaktausprägung die Auswertbarkeit ab. Artefakte, die durch Bewegung
desPatienten oder des Untersuchers entstanden sind oder bereits im 2D-Bild vorhanden
waren,lassen sich meist erst durch die weitere Bearbeitung der Ebenen darstellen. Besonders
deutlich werden z. B.
Bewegungsartefakte beim Verschieben des Würfels oder bei der Wahl desModus Group Plane
MAIN.
Die weitere Bildbearbeitung betreffend wird deutlich, dass Artefakte aus der zweidimensionalen
Darstellung, z. B. distale Schallschatten, Sonderfälle darstellen. Eine guteBildbearbeitung ist
zwar möglich, eine Volumetrie aber aufgrund der Überlagerung nicht.Dies trifft für den Patienten
22493 durch Verkalkungen in der Leber und bei Patient 21715durch Überlagerung mit gasgefüllten
Darmschlingen zu (Abbildung 14).
Die Wahl eines Rendering Modus zur verbesserten 3D-Darstellung erlaubt beim
Auftretenvon Stufe 5 (23 Datensätze) und 6 (19 Datensätze) in Bezug auf Artefakte keine
Auswertung.Insgesamt konnten 42 Datensätze (21,4 %) hier nicht weiter bearbeitet werden. Auch in
denStufen 3 (62 Datensätze) und 4 (52 Datensätze) ist nur eine eingeschränkte
Bearbeitungmöglich, da bei Stufe drei bereits Unregelmäßigkeiten in diesem Modus erkennbar
sind.Insgesamt können 114 Rohdaten (58,8 %) nur eingeschränkt mit diesem Programm vollständig
bearbeitet werden. Die Qualität der Bildbearbeitung zeigte in Narkose eine deutlicheVerbesserung
im Hinblick auf das Auftreten mangelhafter bis ungenügender Rohdatensätze.Ähnlich der
Artefaktausprägung war keine deutliche Zunahme der sehr guten und gutenQualität der Bearbeitung
in Narkose oder bei bereits toten Tieren zu verzeichnen.
3.5.2 Volumetrie
Mit dieser Arbeit sollte überprüft werden, ob sich ein Unterschied in der Messmethode der2D-Volumetrie gegenüber der 3D-Volumetrie an der Leber des Hundes unter denverschiedenen Bedingungen ergibt. In den Tabellen 2 und 3 (Kapitel 3.4.3.5) sind dieerfassten Daten der 2D- und 3D-Messung aufgeführt. Bei Auswertung der für die Volumetriezur Verfügung stehenden Rohdaten zeigte sich, dass 4 Patienten (22241, 23614, 24459 und25421b) einen unvollständigen Scan aufwiesen. Beim Vorliegen mehrerer Zubildungen imParenchym zeigte sich die Zuordnung im Volumen bestimmter Veränderung als schwierig.Dies traf auf 3 Patienten (15895, 21861 und 22342) zu. Ebenfalls war bei zwei Tieren (22515,22565) eine exakte Volumetrie aufgrund schlechter Differenzierung nicht möglich. Daherwurden diese Patienten nicht zur weiteren Auswertung
herangezogen.
Die gemessenen Volumina zeigten mit der Ellipsoidformel einen Mittelwert von 23,46 ml
miteiner Spannweite von 0,13 bis 126,81 ml. Mit der Serial-Methode ergibt sich bei der
3DPlanimetrie ein Mittelwert des Volumens von 28,99 ml mit einer Spannweite von 0,19 bis157,85
ml.
Bei der Anwendung des statistischen Testes wurde aufgrund der Studien von
Riccabona et al. 1996, Elliot et al. 1996 und Lang et al. 1999 davon ausgegangen, dass die 3D-Messung demreellen Volumen entspricht. Um einen eventuellen Unterschied zwischen den Messungenfestzustellen, wurde der t-Test durchgeführt. Dies war möglich, da die Darstellung derrelativen Messfehler in einem Q-Q-Plot nicht gegen eine Normalverteilung sprach (Diagramm16). Bezogen auf die relativen Messfehler ergaben sich ein Maximalwert von 0,47890 und einMinimalwert von -0,66270 mit einem Mittelwert von -0,15640 und einer Standardabweichungvon 0,31704.

Die Anwendung des t-Tests ergab auf dem 5 % Niveau (p=0,031) einen signifikantenUnterschied der relativen Messfehler.
Bei der Überprüfung der Messergebnisse der 2D- und 3D-Volumetrie in Bezug auf die
Formder Leberläsion konnte nach Anwendung des t-Tests ein signifikanter Unterschied
zwischenden Ergebnissen der Volumetrie (p=0,031) festgestellt werden. Die 2D-Mesungen waren
im
Mittel um 15,6 % kleiner als die 3D-Messungen. Bei weiterer Aufschlüsselung des Formeneinflusses
ergab der Test für die elliptischen Läsionen einen hoch signifikanten Unterschied(p=0,0079).
Hier waren die 2D-Messungen im Mittel um 24,7 % kleiner als die 3DMessungen, mit einem Maximalwert von 0,24070, einem Minimalwert von -0,66270 sowieeinem Mittelwert von -0,24720. Die Standardabweichung beträgt 0,26430. Die Ergebnisse fürdie elliptischen Formen sind im Q-Q-Plot (Diagramm 17) aufgeführt. Für die Durchführungdes Tests wurde jeweils das 5 % Niveau angenommen.

Für die beiden weiteren Formenkategorien (geringe Abweichungen vom Ellipsoid undamorphe Läsionen) konnte mittels des t-Tests kein signifikanter Unterschied festgestelltwerden.
Aus
diesen Ergebnissen lässt sich schließen, dass zur Volumetrie von Läsionen die 3DVolumetrie vorzuziehen ist.
3.5.3 Lage der Läsion im Parenchym
Die Lokalisation der Läsionen im Parenchym wurde hinsichtlich ihrer Auswirkung aufentstehende Artefakte und die Bildbearbeitungsqualität überprüft. Im ersten Schritt erfolgteeine Aufstellung der möglichen Lokalisationskombinationen und einer Gruppenzuordnung fürweitere Berechnungen sowohl für wache, als auch für alle Patienten mit fokalen Ver-änderungen. Multiple Läsionen, die randständig oder zwerchfellnah gelegen waren, konntenbei den untersuchten Patienten nicht festgestellt werden (Gruppe 8 und 9 in Tabelle 11).
3.5.3.1 Auswirkung auf Artefakte
Es wurde
die Verteilung der Artefaktstufen mit Angabe des 1. Quartils, Median und 3.Quartils im Hinblick
auf die Lokalisation der Läsion zuerst am wachen Patienten überprüft.Die Ergebnisse sind in
Tabelle 11 enthalten.

Zur Untersuchung der Auswirkung der Lokalisation von Läsionen auf die
Artefaktausprägungwurde ebenfalls der Test auf gemusterten Gruppeneffekt bei Versuchsanlagen für
mehrereGruppen mit abhängigen Messwiederholungen (Brunner und Langer, 1999) verwendet. DieÜberprüfung der Artefakte erfolgte mit den Gewichtsvektoren w=(3;4;5;3;4;3;6) für dieGruppen 1-7. Bei der Annahme von p=0,05 für ein signifikantes Ergebnis ergab der Test
am wachen Patienten für die Überprüfung der
Artefakte mit p=0,00322 einen hoch signifikantenEinfluss der Lokalisation auf die
Artefaktausprägung.Im zweiten Schritt wurde dieser Test auf alle Patienten angewendet, bei denen
fokale Prozesse in der Leber vorlagen, unabhängig davon, ob sie wach, narkotisiert oder nachEuthanasie untersucht wurden. Die Ergebnisse sind in Tabelle 12 enthalten.

Für die Überprüfung der Artefakte wurden folgende Gewichtsvektoren (Artefaktstufen)
fürdie Gruppen 1-7 verwendet: w=(3;4;4;3;3;3;5). Bei der erneuten Annahme von p=0,05 für
einsignifikantes Ergebnis konnte für die Gruppe der Artefakte mit p=0,00571 ein hochsignifikantes Ergebnis erzielt werden. Unabhängig davon, ob die Patienten während derUntersuchung wach oder narkotisiert waren oder die Untersuchung nach der Euthanasieerfolgte, hatte die Lokalisation der Läsion einen hoch signifikanten Einfluss auf dieArtefaktausprägung.
3.5.3.2 Auswirkung auf Bildbearbeitungsqualität
Es wurde die Verteilung der Bildbearbeitungsqualität mit Angabe des 1. Quartils, Median und3. Quartils im Hinblick auf die Lokalisation der Läsion zuerst am wachen Patienten überprüft.Die Ergebnisse sind in Tabelle 13 enthalten.

Zur Untersuchung der Auswirkung der Lokalisation von Läsionen auf die Bildbearbeitungsqualität
wurde ebenfalls der Test auf gemusterten Gruppeneffekt bei Versuchsanlagen fürmehrere Gruppen
mit abhängigen Messwiederholungen (Brunner und Langer, 1999)verwendet. Es wurde für die Überprüfung der Bildbearbeitung der Gewichtsvektor(Bearbeitungsqualität) w=(3,4,5,3,4,3,6) für die Gruppen 1-7 verwendet. Bei der Annahmevon p=0,05 für ein signifikantes Ergebnis ergab der Test für die Überprüfung derBildbearbeitung am wachen Patienten mit p=0,00249 einen hoch signifikanten Einfluss derLokalisation auf die Bildbearbeitungsqualität.
Im zweiten Schritt wurde dieser Test auf alle Patienten angewendet, bei denen fokaleProzesse in der Leber vorlagen, unabhängig davon, ob sie wach, narkotisiert oder nachEuthanasie untersucht wurden. Die Ergebnisse sind in Tabelle 14 enthalten.

Für die Überprüfung der Bildbearbeitungsqualität wurden folgende Gewichtsvektoren für dieGruppen 1-7 verwendet: w=(3,4,4,3,3,3,5). Bei der erneuten Annahme von p=0,05 für einsignifikantes Ergebnis konnte für die Gruppe der Bildbearbeitung mit p=0,00448 ein hochsignifikantes Ergebnis erzielt werden. Unabhängig davon, ob die Patienten während derUntersuchung wach oder narkotisiert waren oder die Untersuchung nach der Euthanasieerfolgte, hatte die Lokalisation der Läsion einen hoch signifikanten Einfluss auf dieArtefaktausprägung.
Zusammenfassend kann also ein hoher Einfluss der Lokalisation der Parenchymläsion auf dieAusprägung von Artefakten und die Qualität der Bildbearbeitung statistisch nachgewiesenwerden. Die Gruppen 3, 5 und 7 sind bei der Betrachtung aller Patienten eine Stufe bessereinzuordnen.
4 Diskussion
In der Veterinärmedizin gibt es bislang nur wenige Arbeiten über den Einsatz vondreidimensionalem Ultraschall (Edinger und Koneberg 2001, Poulsen Nautrup 2001, Wagels
und Stadler 2004), dessen technische Grundlagen und seine notwendigen Voraussetzungen
(Poulsen Nautrup 2001). Die vorliegenden Arbeiten stammen aus unterschiedlichen Gebieten,wie z. B. Echokardiographie beim Kleintier (Poulsen Nautrup 2004) oder der Sehnen- undGelenkdiagnostik beim Pferd (Edinger und Koneberg 2001, Wagels und Stadler 2004). Inzwei
veterinärmedizinischen Lehrbüchern der Sonographie wird die Möglichkeit desdreidimensionalen
Schalls angesprochen, aber nicht näher ausgeführt (Poulsen Nautrup 2001, Mattoon et al. 2002). Die Zielsetzung dieser Arbeit sollte sein, grundlegende Voraussetzungen für die Erstellung von
dreidimensionalen Bildern an der Leber zu erarbeiten undAussagen über die Möglichkeiten und
Voraussetzungen des klinischen Einsatzes zu treffen.
4.1
Methodik
Die
Vorbereitung des Patienten erfolgt wie bei allen sonographischen Untersuchungen desBauchraumes.
Das Fell muss auf eine Haarlänge von 1/10 mm geschoren werden (Gerwing 1989). Sowohl für die zweidimensionale, als auch die dreidimensionale Sonographie müssendie Tiere nüchtern sein, damit keine Überlagerungen durch den gefüllten Magen entstehen (Barr 1992, Gerwing 1993b, Lamb 1995, Selcer 1995, Partington und Biller 1996, Nyland et al. 2002b). In dieser Studie waren alle Tiere mindestens 12 Stunden ohne Futter. Für denKontakt zwischen Haut und Schallkopf wird handelsübliches Ultraschallgel oder beinachfolgenden Biopsien alternativ Alkohol verwendet. Der Ultraschall der Leber erfolgt beimMenschen in Rückenlage oder Seitenlage (Schuler und Börner 2001). Für diezweidimensionale Untersuchung beim Hund sind sowohl die Rücken- als auch die Seitenlagemöglich (Barr 1992, Partington und Biller 1996, Nyland et al. 2002b), in unserem Haus wirddie Lagerung auf dem Rücken bevorzugt (Gerwing 1989). Die dreidimensionale Sonographieempfiehlt sich gleichfalls in dieser Position, damit durch eine Umlagerung der Patient nicht inUnruhe gerät. Zusätzlich erlaubt diese Position dem Untersucher eine genaue Orientierung, sodass die Zuordnung von Veränderungen zu betreffenden Organen leichter fällt. Für dieErstellung der 3D-Bilder lässt sich der notwendige Magnet direkt in Höhe der Leberaufstellen. Es dürfen sich keine eisenhaltigen oder leitenden Metalle in der Nähe desMagneten befinden (Downey et al. 2000). Zur Vermeidung von Artefakten müssenGegenstände zwischen Sensor und Magneten entfernt und der Magnet möglichst dicht
amline
Sensor aufgestellt werden (Downey et al. 2000, Nelson et al. 2000). Genaue Erläuterungenüber den Abstand von metallischen Gegenständen zum Magneten liegen in der Literatur nichtvor. Um mögliche Einflüsse durch Brustgeschirre zu vermeiden, wurden diese vor derUntersuchung abgelegt. Die Positionierung auf hölzerner Tischplatte und Lagerungskissen istnach den vorliegenden Ergebnissen ausreichend, um durch Metall (z. B. Tischgestell) entstehende Artefakte zu
vermeiden.
Die zweidimensionale sonographische Untersuchung der Leber wird in der Humanmedizinmit Curved- oder Sektortransducern (3,5-5 MHz) durchgeführt. In einigen Fällen wird auchauf höherfrequente Sonden umgestellt (Strohm und Gladisch 1992, Schuler und Börner 2001).Zur Untersuchung am Tier ist die Verwendung von Linear-, Konvex- sowie auch Sektorschallköpfe mit Frequenzen von 5-7,5 MHz beschrieben (Nyland et al. 2002b, Peppler et al. 2005). Die Verwendung einer Defokussierungslinse sowie die Freihandtechnik mit oder ohneSensor ist mit den genannten Schallköpfen möglich (Downey et al. 2000, Sakas et al. 2000, Köstering et al. 2002, Fenster und Downey 2003). Die dreidimensionale Rekonstruktionerfolgt nach Speichern einer bestimmten Anzahl von 2D-Bildern (Köstering et al. 2002). Füreine Volumetrie ist zusätzlich ein Sensor mit dazu passendem Aufsatz notwendig (Downey et al. 2000, Köstering et al. 2002, Fenster und Downey 2003). Eine weitere Möglichkeit derAufnahmetechnik bietet der integrierte 3D-Schallkopf. Er ermöglicht eine Volumetrie ohnezusätzliche Hilfsmittel (Köstering et al. 2002). In unserer Studie wurden Konvexschallköpfein der Frequenz von 4-7 MHz und Linearschallköpfe in der Frequenz von 9-12 MHz mitAufsatz und Sensor zur Volumetrie verwendet. Die angewendete Frequenz muss dem zuuntersuchenden Objekt angepasst werden. Die in der Veterinärmedizin beschriebenenFrequenzangaben liegen über dem in der Humanmedizin verwendeten Frequenzbereich, wasdurch die Größe der Objekte im Kleintierbereich zu erklären ist. Mit Erhöhung der Frequenzkonnte in dieser Studie eine höhere Bildqualität erzielt werden.
4.2
Untersuchungsgang
Voraussetzung für die Durchführung eines dreidimensionalen Untersuchungsganges ist dasVorliegen einer fokalen Organveränderung, da bei diffusen Erkrankungen keine Verbesserungder Aussage durch die dreidimensionale Darstellung möglich ist (Wagner et al. 1994). DieseAussage deckt sich mit unseren Untersuchungen. Eine weitere Verarbeitung der Datensätzebei diffus inhomogenen Leberveränderungen war nicht möglich. Die zweidimensionaleSonographie der Leber erfolgt in Längs- und Querrichtung, wobei in beiden EbenenSerienschnittbilder angefertigt werden (Nyland et al. 2002b). Für die 3D-Untersuchung istlediglich ein gleichmäßiger Schwenk mit dem Sensor in Richtung des Magneten notwendig,um alle Daten zu erheben. Beim klinischen Einsatz der dreidimensionalen Untersuchung istdie Erstellungsdauer der Datensätze wichtig, da diese in dem diagnostischen und ggf.therapeutischen Ablauf eingeplant werden muss. In der humanmedizinischen Literatur werden0,2 bis ca. 10 Sekunden als Rekonstruktionszeit angegeben (Köstering et al. 2002). Die in derVeterinärmedizin von Poulsen Nautrup 2001 angegebene Zeit zur Erstellung einesRohdatensatzes beträgt 2-5 Sekunden. Diese Angaben stimmen mit denen von unsgemessenen 4,5-5 Sekunden als Scanzeit überein. Der Aufbau des 3D-Bildes dauerte inunseren Untersuchungen 25-30 Sekunden und ist damit deutlich länger als die von Köstering et al. 2002 beschriebene Rekonstruktionszeit. Für die weitere Bearbeitung dieses Rohdatensatzes ist die Größe des Objektes wichtig, da eine exakte Volumetrie nur möglich ist, wenndas Objekt mit einem Schwenk erfasst wurde. Sind bei großen Veränderungen mehrereAnsätze notwendig, kann es zu fehlerhaften Ergebnissen kommen (Treece et al. 2001). DieVolumetrie konnte in dieser Studie bei 4 von 49 Patienten (8,2 %) nicht vorgenommen werde,da nicht alle Anteile der Veränderung im Datensatz enthalten waren.
4.3
Bildbearbeitung
4.3.1
Artefakte
Die
Ausbildung von Artefakten im Rohdatensatz ist für eine weitere Bildbearbeitung vonentscheidender
Bedeutung (Nelson et al. 2000). Zusätzlich zu den bereits im 2D-Bildenthaltenen Artefakten kommen 3D-bedingte Kunstprodukte hinzu. Dabei handelt es sich umso genannte Akquisitionsartefakte, Rendering Artefakte und Erstellungsartefakte (Nelson et al. 2000). Um Akquisitionsartefakte zu vermeiden, darf sich der Patient während derUntersuchung nicht bewegen, weshalb der Scan beim Menschen in Atempausen erfolgt (Nelson et al. 2000). Diese Form von Artefakten ist direkt bei der Erstellung erkennbar, sodass der Scan sofort wiederholt werden kann (Nelson et al. 2000). Eine Sedation ist beimMenschen durch dessen Mitarbeit nicht erforderlich. Auch für das Tier ist die Untersuchungim wachen Zustand beschrieben (Poulsen Nautrup 2001). Die Auswertung der eigenenErgebnisse zeigt, dass am wachen Patienten ca. 20 % aller durchgeführten Rohdatensätze einsehr gutes bis gutes Ergebnis liefern. Gleichzeitig mussten ca. 30 % der Datensätze in Stufe 5(mangelhaft) und 6 (ungenügend) eingeteilt werden. Bei den Untersuchungen in Narkosezeigten ca. 12 % sehr gute bis gute Ergebnisse, während 2 % der Daten nicht verwertbarwaren. In den Stufen 3 (befriedigend) und 4 (ausreichend) konnten bei wachen Patienten 50
%
der Daten eingeordnet werden, in Narkose waren es 85 %. Der Einsatz einer Narkosereduzierte
deutlich das Auftreten von Artefakten und damit von Aufnahmen, die nichtauswertbar waren. Um
Atmungsartefakte zu vermeiden, könnten dem Tier auch Mund undNase zugehalten werden (Poulsen Nautrup 2001). Diese Methode wurde von uns nichtdurchgeführt, da hechelnde Tiere beim Zuhalten von Mund und Nase, sofern dies nicht nursehr kurzfristig erfolgt, mit noch mehr Unruhe und folglich auch Bewegungen reagierten.Aufgrund dieser Ergebnisse empfehlen wir für die Erhebung von dreidimensionalenDatensätzen die Sedation oder Anästhesie der Hunde.
Eine weitere Möglichkeit zur Entstehung von Akquisitionsartefakten ist die Bewegung
desUntersuchers. Der Schallkopf muss ruhig und in gleichmäßigem Tempo geführt werden
(Poulsen Nautrup 2001, Downey et al. 2000, Bailey et al. 2001). Für die Ausführung diesergleichmäßigen Bewegung ist einige Erfahrung des Untersuchers notwendig. Zur Erprobungoder Übung ist die Untersuchung am toten Tier geeignet, da hier auftretende Artefakteausschließlich auf den Untersucher zurückzuführen sind. In dieser Studie wurden dieeuthanasierten Tiere zu Beginn untersucht. 8 von 14 der auf diese Art erhobenenRohdatensätze (57 %) mussten in die Artefaktstufe 3, ein Datensatz von 14 (7 %) in dieArtefaktstufe 4 eingeordnet werden. Insgesamt entsprachen diese Zahlen 64 % derUntersuchungen, bei denen der Einfluss durch den Untersucher hochgradig war. In derReihenfolge der erhobenen Datensätze zeigten die zuletzt Durchgeführten die bestenErgebnisse (Anhang, Tabelle D/H). Diese Untersuchungen bestätigen die Angaben derLiteratur über den Einfluss des Untersuchers auf Akquisitionsartefakte. Es ist anzunehmen,dass bei zunehmender Erfahrung des Untersuchers der Anteil der wach zu untersuchendenPatienten ansteigt.
Die Akquisitionsartefakte konnten auch in dieser Studie bei Artefaktstufe 5 und 6(hochgradige Unschärfen) direkt erkannt werden und wurden durch erneute Rohdatensätzeersetzt, wie auch von Nelson et al. 2000 beschrieben. In der Humanmedizin gibt es keinevergleichbare Einteilung der Artefaktstufen, so dass nicht erkennbar ist, ab welcherArtefaktstärke hier eine Wiederholung durchgeführt wurde. In den Artefaktstufen 3 und 4 sindmögliche Artefakte erst bei Durchfahrung des Würfels erkennbar, so dass sie erst bei derBearbeitung auffielen. Wird die Bearbeitung zeitlich getrennt von der Erstellung derRohdaten vorgenommen, so kann der Patient durchaus noch mal zur Untersuchung einbestelltwerden, wie es bei Humanpatienten üblich ist (Nelson et al. 2000). Sollte eine erneuteWiedervorstellung durch lange Anfahrtszeit problematisch sein, können aufgrund der niedrigen Erstellungszeiten direkt mehrere Datensätze erhoben werden, so dass sicher einguter bis befriedigender Datensatz zur weiteren Bearbeitung zu Verfügung steht.
Da in der Sonographie die Strahlenbelastung für Untersucher und Patient entfällt, könnenbeim Vorliegen von nicht auswertbaren Datensätzen beliebig viele Scans problemlosangefertigt werden (Nelson et al. 2000, Sakas et al. 2000).
4.3.2 Würfelmodell
Das
Würfelmodell ist eine Möglichkeit der dreidimensionalen Darstellung der erfasstenInformationen
auf dem Monitor (Downey et al. 2000, Poulsen Nautrup 2001, Köstering et al. 2002) und wurde in dieser Arbeit zur Visualisierung der Daten verwendet. Bei derDurchführung der Bildbearbeitung zeigte sich, dass das Würfelmodell und die enthaltenenDarstellungsmöglichkeiten der erste wichtige Schritt im Hinblick auf die Überprüfung derBildqualität und das Vorliegen von Artefakten darstellt. Es kann sehr rasch entschiedenwerden, ob eine weitere Bearbeitung im Renderingprogramm oder eine Volumetrie möglichsind, oder ob eine neue Datenerstellung erfolgen muss. Nur Datensätze mit maximalmittelgradigen Artefakten lassen eine Bearbeitung im Würfelmodell zu. In unserenUntersuchungen konnten 152 der 194 Datensätzen (78,4 %) in Artefaktstufe 1 (keineerkennbaren Artefakte) bis 4 (mittelgradige Unschärfen, mittelgradige 2D-Artefakte, mittelgradige reflexarme
Querstreifung) eingeordnet werden. Davon waren 149 Rohdaten (98 %)weiter zu bearbeiten.
Zusätzlich ließ sich im Modell feststellen, ob eine Veränderung in derLeber vollständig erfasst
wurde. Die Bearbeitung im Würfelmodell lieferte bereits sehr guteEindrücke über die Ausdehnung
einer Zubildung und deren Verhalten zum umliegendenGewebe. Dieser Vorteil der 3D-Darstellung
wird in der Literatur beschrieben. Die Erläuterunghierfür ist, dass innerhalb eines
Volumenmodells (hier Würfelmodell) jeder sonographischerfassbare Punkt exakt dem Raum und seiner
Nachbarschaft zugeordnet wird (Poulsen Nautrup 2001). Durch die verschiedenen Wahlmöglichkeiten an Bearbeitungsmodi bestehtdie Möglichkeit, je nach Fragestellung die entscheidenden Ebenen zueinander odernebeneinander aufzuzeigen (Poulsen Nautrup 2001). Diese Aussage wurde in unserenUntersuchungen bestätigt. Nach unseren Berechnungen stellten wir in Bezug auf dieBearbeitungsqualität keinen signifikanten Unterschied zwischen narkotisierten oder wachenPatienten fest. Zu dieser Fragestellung liegen in der bestehenden veterinärmedizinischenLiteratur keine Angaben vor. Durch die bestehende Kooperation des Menschen stellt sichdiese Frage in der Humanmedizin nicht
4.3.3 Renderingprogramm
Mit Hilfe des Renderingprogrammes lassen sich 3D-Effekte noch besser erzielen undunterschiedliche Oberflächenstrukturen besser darstellen. Dazu werden die ParameterThreshold und Opacity variiert (Downey et al. 2000, Nelson et al. 2000, Sakas et al. 2000).Das Programm des Volume Rendering kann allerdings nur dann gute Resultate erzielen, wennder Rohdatensatz möglichst geringe Artefaktausprägungen aufweist. Die Auswertbarkeit derDatensätze zeigte bereits in Stufe 3 zu den Unschärfen in der Coronarebene auchUnregelmäßigkeiten im Renderingmodus. Nur 47 der insgesamt 194 Datensätze (24,2 %)waren vollständig mit diesem Programm zu bearbeiten. Die Vielzahl an Kombinationsmöglichkeiten, die hier zur Bearbeitung verfügbar sind, ermöglichte es verschiedene Fragestellungen, z. B. bessere Visualisierung von Tumoren und Zysten, zu bearbeiten (Sakas et al. 2000). Durch vorsichtigen Einsatz der Parameter Threshold und Opacity können undeutlicheParenchymveränderungen durch stärkere Kontrastierung hervorgehoben werden. Allerdingsbirgt dies die Möglichkeit, dabei erneut Artefakte, die so genannten Rendering Artefakte, zuproduzieren (Nelson et al. 2000). Diese Artefaktbildung fanden wir in unserenUntersuchungen ebenfalls vor. Informationen können durch massiven Einsatz z. B. derParameter Threshold und Opacity sowie durch unterschiedliche Kombinationen von Textureund Grey Surface verloren gehen (Nelson et al. 2000). Ein eindrucksvolles Beispiel dafür warder Patient 25163. Durch unterschiedliche Wahl der Parameter, in diesem Fall eineKombination aus Grey Surface und keine Einstellung Typ 2, war ein kleiner reflexarmerRundherd im Parenchym neben einem großen reflexreichen Rundherd nicht mehr erkennbar(siehe Abbildungen 16-18). Über diese Artefakte liegen keine veterinärmedizinischenBerichte vor, andererseits sind Angaben und Hinweise aus der Humanliteratur übertragbar. Downey et al. 2000 empfehlen zur Vermeidung solcher Artefakte, die Ergebnisse nach demRendering-Vorgang mit den Originalrohdaten zu vergleichen. Nach unseren Erfahrungen istein solcher Vergleich notwendig.
4.4
Volumetrie
Die
Volumenbestimmung von pathologischen Befunden ist ein wichtiger Punkt in derbildgebenden
Diagnostik (Lang et al. 1999, Scharf und Sohn 2002). Größenbestimmungendieser Veränderungen lassen sich sehr gut im 2D-Bild vornehmen (Lang et al. 1999). EineVolumenberechnung im zweidimensionalen Bild erfolgt mit der Ellipsoidformel, nachdemLänge, Breite und Tiefe des Objektes in zwei senkrecht zueinander liegenden
Ebenen
bestimmt wurden (Knauff 1987, Gerwing 1989, Braun 1992a, Braun 1992b, Lang et al.
1999,
Fenster und Downey 2003). Diese Formel setzt allerdings die Gleichförmigkeit vonpathologischen Veränderungen voraus (Lang et al. 1999, Fenster und Downey 2003). In derklinischen Anwendung zeigte sich, dass z. B. Tumoren oder zystische Gebilde nicht immereine einfache geometrische Struktur aufweisen (Lang et al. 1999, Fenster und Downey 2003).Zusätzlich liegen in der zweidimensionalen Berechnung die drei Ebenen nicht immerorthogonal zueinander, so dass weitere Messfehler entstehen können (Gilja et al. 1999, Lang
et al. 1999, Poulsen Nautrup 2001). Am Beispiel der Prostata konnte von Tong und Mitarbeitern 1998 in einer vergleichenden Studie zwischen zweidimensionaler unddreidimensionaler Volumenberechnung eine niedrigere Variabilität und eine höhereReliabilität zugunsten der 3D-Berechnung ermittelt werden. In weiteren humanmedizinischenStudien wurde die 3D-Volumetrie auf ihre Exaktheit hin überprüft (Ließ et al. 1994, Elliot et al. 1996, Riccabona et al. 1996, Wong et al. 1996, Lang et al. 1999, Strommen et al.
2004).Die auch in unserer Studie verwendete manuelle Volumenbestimmung oder
Serial-Methodewird häufig zur 3D-Planimetrie herangezogen (Lang et al. 1999, Fenster und Downey 2003).Sie
bietet den Vorteil der exakten Umfahrung des pathologischen Befundes im normalen 2DBild und der anschließenden Durchmusterung im Würfelmodell, so dass hier in beliebigenTiefen der Befund umfahren werden kann (Fenster und Downey 2003). Die Bildung einesReferenzwertes erfolgte in den genannten Studien z. T. über die Wasserverdrängung (Elliot et al. 1996, Riccabona et al. 1996, Strommen et al. 2004) oder über einecomputertomographische Volumenbestimmung (Lang et al. 1999). Eine Verifizierung der inder vorliegenden Studie gemessenen Volumina wurde an unseren lebenden klinischenPatienten nicht erneut durchgeführt, da bereits aussagekräftige Untersuchungen zur 3DVolumetrie vorliegen.
Daher wurden die bestehenden Ergebnisse in Bezug auf die größereGenauigkeit aus der
dreidimensionalen Volumetrie als Referenzwerte übernommen. Hierstanden mit 100 Rohdatensätzen 51
% der Daten nicht zur Volumetrie zur Verfügung. Das lagzum großen Teil an der zusätzlichen
Untersuchung von Patienten ohne fokale Veränderung(37 %), aber auch daran, dass bei 23 % der
Datensätze die Artefakte zu stark (Stufe 6)ausgeprägt waren. Grundsätzlich müssen hier auch die
Artefakte aus der 2D-Sonographie (z.B. Gas im Magen-Darm-Trakt) berücksichtigt werden, so dass
eine entsprechendeVorbereitung des Patienten (fasten) notwendig ist (Barr 1992, Gerwing 1993b, Lamb 1995, Selcer 1995, Partington und Biller 1996, Nyland et al. 2002b). Da bei den Patienten zum Teiltrotz einer Nahrungskarenz von 12 Stunden noch Gasartefakte aufgetreten sind, ist vor einervolumetrischen Untersuchung ein längerer Nahrungsentzug notwendig.
Pathologische
Parenchymbefunde wurden nach ihrer Form in drei Kategorien eingeteilt: ellipsoid,geringgradige
Abweichung von der ellipsoiden Form und unregelmäßig. Die Berechungenerfolgten dreimal mit der
Ellipsoidformel am 2D-Bild und dreimal im 3D-Programm mit derSerial-Methode. Es konnte gezeigt
werden, dass in jedem Fall aufgrund der größerenGenauigkeit die 3D-Planimetrie der 2D-Messung
zur Volumenbestimmung vorzuziehen ist.Die Zahl der unförmigen Läsionen ist in dieser Studie mit
5 von 24 (20,8 %) gering.Kategorie 2 konnte ebenfalls nur bei 6 der 24 Veränderungen (25 %)
festgestellt werden. Fürdiese beiden Formen konnte kein signifikanter Unterschied gefunden
werden. Dies istmöglicherweise durch die geringe Patientenzahl zu erklären. Angaben über die
Häufigkeitvon nicht geometrischen Formen bei Zysten oder Tumoren werden in der Literatur
nichtgemacht. Bei der Formkategorie 1 (ellipsoid), deren Anteil 13 von 24 Läsionen (54,2
%)ausmachte, konnte ein hoch signifikanter Unterschied zwischen der 3D-Volumetrie und
derzwei-dimensionalen Volumenberechnung festgestellt werden. Die möglichst exakteVolumetrie von Organläsionen ist in der Humanmedizin von großer Bedeutung (Leppek und Klose 1995, Lang et al. 1999, Rose et al. 2001a, Rose et al. 2001b). In der Überwachung vonTumorerkrankungen ist eine regelmäßige Größenbestimmung von pathologischen Befundennotwendig, um eine Verlaufskontrolle z. B. unter Chemotherapie zu erhalten (Lang et al. 1999, Rose et al. 2001b). Mit Hilfe der 3D-Sonographie steht ein nichtinvasives und ohneStrahlenbelastung arbeitendes System zur Verfügung, dessen Anwendung beliebig häufigwiederholt werden kann (Lang et al. 1999, Nelson et al. 2000, Sakas et al. 2000). DieBereitschaft der Tierbesitzer, bei ihren Haustieren eine Tumortherapie durchzuführen, steigtimmer mehr (Kessler 2005). Infolgedessen ist auch eine regelmäßige Kontrolle dieserPatienten während einer Tumorbehandlung immer häufiger notwendig und eine möglichstschonende diagnostische Methode wünschenswert. Eine frühzeitige Einschätzung, ob einTherapieerfolg nach einer Chemotherapie vorliegt, wäre somit ohne größere Belastungmöglich und erlaube bei Ausbleiben des Erfolges eine rasche Änderung des Therapieplans.Auf diese Weise könnten dem Patienten unnötige Leiden durch die Therapie erspart bleiben.Zusätzlich ist die dreidimensionale Sonographie nicht nur in den Anschaffungskosten,sondern auch in den Anwendungskosten deutlich niedriger als vergleichsweise ein CT oderMRT. Für die Durchführung dieser beiden Methoden ist außerdem immer eine Narkose, ggf.sogar eine Inhalationsnarkose notwendig. Mit der dreidimensionalen Sonographie besteht beiguter Kooperation des Patienten die Möglichkeit vollständig auf eine Narkose zu
verzichten.
4.5 Lage der Läsion im Parenchym
Über einen Einfluss der Lage der Läsion auf weitere Bearbeitungsmöglichkeit lagen bisherkeine Angaben in der humanmedizinischen und veterinärmedizinischen Literatur vor. In dendurchgeführten Untersuchungen im Rahmen dieser Arbeit konnte sowohl für die wachenPatienten als auch für die gesamte Patientenzahl ein hoch signifikanter Einfluss derLokalisation auf die Artefaktausbildung und Bildbearbeitungsqualität festgestellt werden,wenn man die Klientel mit inhomogenen Veränderungen herausnimmt. Die linksseitiggelegenen Veränderungen traten häufiger auf und zeigten bessere Ergebnisse als dierechtsseitigen. Die Ausnahme hiervon bilden die linksseitig-zwerchfellnahen Veränderungen,die die schlechtesten Ergebnisse lieferten. Möglicherweise ist die Anfertigung des Scans beidieser Lokalisation für einen Rechtshänder (wie die Autorin dieser Arbeit) am schwierigstendurchzuführen. Ebenfalls unbefriedigende Ergebnisse zeigten die zentral gelegenen Läsionen,die multiple im Parenchym auftraten. Bei diesen multiplen Veränderungen spieltmöglicherweise die schwierige Fokusierung des Untersuchers auf eine Zubildung eine Rolle.Rein subjektiv betrachtet erscheint es schwieriger mehrere Zubildungen in einemRohdatensatz gleichmäßig zu scannen, so dass alle Anteile die gleicheBildbearbeitungsqualität besitzen. Randständige Zubildungen waren gut auswertbar.
4.6 Biopsie / Punktion der
Leber
Die
Biopsie oder Punktion von Tumoren im Bereich der Leber ist für die weitere Diagnostikvon
entscheidender Bedeutung, da allein aufgrund sonographischer Befunde keineEinschätzung des
Befundes möglich ist (Gerwing 1993b, Partington und Biller 1996, Selcer
1995, De Rycke et al. 1999, Schuler und Böhner 2001, Nyland et al. 2002b, Wang et al.
2004, Peppler et al. 2005). Durch den Einsatz der Sonographie zur Punktion oder Biopsie könnengezielt Proben aus der Leber entnommen werden (Gerwing 1993b, Partington und Biller
1996, Selcer 1995, De Rycke et al. 1999, Schuler und Böhner 2001, Nyland et al. 2002a,
Wang et al. 2004, Peppler et al. 2005). Die Biopsie der Leber im 3D-Modus wird in derLiteratur beschrieben (Polaków et al. 2003). Die Durchführung der Biopsie in diesem Moduswar nicht Thema dieser Studie und erfordert weitergehende Software. Diese Methodeerscheint auf dem Hintergrund der in dieser Dissertation erarbeiteten Informationen undMöglichkeiten als sehr interessantes und klinikbezogenes Vorhaben. Zusätzlich zurdiagnostischen Biopsie der Leber ist auch eine therapeutische Punktion fokaler Leberherde,z. B. zur Injektion von Ethanol, möglich (Tucker De Sanctis et al. 1998, Rose et al. 2001b).
Mit Hilfe des dreidimensionalen Ultraschalls können weitergehende Informationen überPlatzierung und Verteilung des injizierten Agens gewonnen werden (Rose et al. 2001b).Hierin sind Möglichkeiten für Studien in der Veterinärmedizin zu sehen. Eine Kombinationvon Diagnostik (Befunderhebung), Therapie sowie Therapiekontrollen mit 3D-Techniken beiLebererkrankungen wäre zu überprüfen.
4.7 Vor- und Nachteile des
3D-Ultraschalls
In der
humanmedizinischen und veterinärmedizinischen Literatur werden verschiedene Vorund Nachteile der dreidimensionalen Sonographie aufgeführt. Für den Patienten ergibt sichdurch die zusätzliche Datensatzerhebung keine wesentliche Verlängerung derUntersuchungszeit (Poulsen Nautrup 2001). Als Nachteil der zusätzlichen 3D-Methode wirdder notwendige Zeitaufwand durch die anschließende Bildbearbeitung aufgefasst (Poulsen Nautrup 2001). Ein solcher Aufwand konnte in unserer Studie nicht als gravierend festgestelltwerden, da die durchschnittliche Bearbeitungszeit bei 8,2 Minuten lag. Da die Anwesenheitdes Patienten während der Nachbereitungsphase nicht mehr erforderlich ist, kann allerdingseine erneute Datenerstellung, die sich dabei aufgrund mittelgradiger Artefakte als notwendigerweist, nicht mehr durchgeführt werden (Nelson et al. 2000). Humanpatienten werden insolchen Fällen erneut zur Untersuchung bestellt (Nelson et al. 2000). Diese Möglichkeitbesteht grundsätzlich auch für Veterinärpatienten, bedingt es aber für den Besitzer einengrößeren Aufwand an Zeit und Kosten. Um dieses Problem zu umgehen, können direktmehrere Datensätze erhoben werden, so dass gute Sequenzen zur weiteren Bearbeitungvorliegen. Durch den niedrigen Zeitaufwand, den eine Datensatzerhebung erfordert, ist dieproblemlos möglich. Sollen Patienten mehrfach sonographiert werden, z. B. zur Kontrolle vonTumormetastasen, so besteht in der Veterinärmedizin die Möglichkeit, im Gegensatz zu CTund
MRT-Untersuchungen, die Untersuchung ohne Narkose durchzuführen. Dies ist in Bezugauf das häufig
höhere Alter der Patienten, in unserer Studie im Durchschnitt 10,24 Jahren,neben dem
zusätzlichen Zeitaufwand und den Mehrkosten durch das nicht zuvernachlässigende Narkoserisiko
als sehr wichtiger Vorteil anzusehen.
Während der zweidimensionalen Sonographie muss der Untersucher die Bilder im Kopf zueinem dreidimensionalen Bild zusammenfügen, um eine räumliche Vorstellung zu erhalten.Mit Hilfe des 3D-Programmes wird diese Arbeit dem Untersucher abgenommen, so dass auchweniger Erfahrene Parenchymläsionen erkennen können (Downey et al. 2000, Fenster und Downey 2003). Eine Überprüfung dieser These war nicht Thema dieser Arbeit. DieAuswertung sowohl zweidimensionaler als auch dreidimensionaler Daten erfordert
eine Einarbeitung, da auch während der Bildbearbeitung noch Fehler und Artefakte auftretenkönnen. Dies belegen die besseren Ergebnisse der später erstellten Rohdaten verglichen mitdenen der ersten Patienten.
In einer Studie aus dem Bereich der Human-Gynäkologie wird der Vorteil derdreidimensionalen Sonographie mit der zweidimensionalen Untersuchung verglichen. Hierkonnte keine deutliche Verbesserung der Diagnostik durch den Einsatz der 3D-Technikfestgestellt werden (Scharf et al. 2001).
Vorteile in Bezug auf die klinische Anwendung, z. B. zur Planung eines chirurgischenEingriffs (Lang et al. 1999) oder Volumenveränderungen nach Therapiemaßnahmen, müssenin weiteren Studien überprüft werden. In einer Studie von Grenacher et al. 2005 konntegezeigt werden, dass die 3D-Darstellung der Leberanatomie zu einer verbessertenOperationsplanung sowohl bei erfahrenen als auch bei unerfahrenen Chirurgen führt. Bei demVergleich in der Anwendung zwischen Humanmedizin und Veterinärmedizin muss sicherauch die unterschiedliche Leberanatomie zwischen Mensch und Hund berücksichtigt werden.Eine Tumoroperation beim Hund ist durch die Lobulierung deutlich einfacher als beimMenschen.
Der Kostenaufwand für ein solches System liegt im Falle des LOGIQ9 der Firma GE bei
ca.5000 Euro, wobei in diesem Gerät alle drei Softwaretypen zur 3D-Darstellung zur
Verfügungstehen. Hier lässt sich ein deutlicher Unterschied zwischen der humanmedizinischen
undveterinärmedizinischen Literatur feststellen. Während in der Humanmedizin von
einerkostengünstigen Möglichkeit gesprochen wird (Sakas et al. 2000), sind in derVeterinärmedizin derartige Beträge als erhebliche Mehrkosten zu bezeichnen (Poulsen Nautrup 2001). Inzwischen sind einzelne 3D-Software-Pakete im Handel erhältlich, diedeutlich kostengünstiger sind. Die Kosten für das Easy 3D liegen bei ca. 1850 Euro, das Advanced 3D ist für ca. 3120 Euro erhältlich. Diese beiden Programme bieten allerdingskeine Möglichkeit zur Volumetrie. Die laufende Entwicklung bietet inzwischen preislichinteressante Perspektiven, so dass der Einsatz von 3D-Ultraschall auch in kleinerenveterinärmedizinischen Einrichtungen finanzierbar wird.
5 Zusammenfassung
Die dreidimensionale Sonographie wird seit Ende der 80iger Jahre des letzten Jahrhunderts inder Humanmedizin in verschiedenen Disziplinen eingesetzt. Während in der Gynäkologie dieOberflächendarstellung zur fetalen Missbildungsdiagnostik genutzt wird, hilft eine exakteVolumetrie mit Sensortechnik bei onkologischen Verlaufskontrollen. In der Veterinärmedizinwerden seit einiger Zeit die Einsatzmöglichkeiten ebenfalls bei Groß- und Kleintierenüberprüft. Da für das Organ Leber bisher keine genauen Angaben zur Anwendung der 3DSonographie vorliegen,
ist diese Arbeit als Grundlagenforschung gedacht.
Die Ultraschalluntersuchungen für diese Arbeit erfolgten mit dem Gerät LOGIQ 9 der
FirmaGeneral Electric (GE). Als Aufnahmetechnik wurde die Freihandtechnik mit Positionssensor gewählt, als Bearbeitungsprogramm stand das Tru 3D zur Verfügung. ImRahmen dieser Studie wurden 49 Hunde mit Leberveränderungen sonographisch untersucht.Das Alter der Patienten lag zwischen 2 und 15 Jahren, bei einem Durchschnittsalter von 10,24Jahren. Die Geschlechtsverteilung ergab 27 männliche und 22 weibliche Tiere. Bei denPatienten wurden multiple Veränderungen, wie z. B. Tumoren (n=37), Zysten (n=5) undVerkalkungen (n=2) festgestellt. Bei vier Patienten wies die Leber eine hochgradigeInhomogenität auf. Zusätzlich zeigte ein Patient eine Gallenblasenveränderung (Mucocele).Bei 24 Patienten wurden ultraschallgezielte Proben aus den Veränderungen entnommen undanschließend zytologisch oder pathologisch-histologisch untersucht.
Erste Untersuchungen wurden an drei euthanasierten Tieren durchgeführt, um den Einflussdes
Untersuchers auf die Bildqualität zu überprüfen. Anschließend erfolgte die Erhebung der3D-Rohdatensätze an 34 wachen und 9 narkotisierten Patienten. Drei Patienten konntensowohl mit als auch ohne Narkose untersucht werden. Alle erhobenen Datensätze wurden aufdie Ausprägung von 3D spezifischen Artefakten z. B. Akquisitionsartefakte und auf vorliegende Bildbearbeitungsqualität (multiplanare Reformation, transparente Darstellung, Volumetrie) hin untersucht. Der Einfluss der Lokalisation der Läsion auf die weitereBildbearbeitung wurde ebenfalls überprüft. Zusätzlich erfolgte ein Mess-Vergleich zwischen2D-Berechnung mit Ellipsoidformel und 3D-Volumetrie (Serial-Methode) von fokalenHerden bei 24 Patienten. Bei einem Teil der Patienten (n=10) erfolgte die Messung der Zeitzur Erstellung und weiteren Verarbeitung der Datensätze stichprobenartig.
Die Untersuchung der Hunde erfolgte nüchtern, in Rückenlage und mit geschorenem
Bauch.Der zur Untersuchung notwendige Magnet wurde in Höhe der Leber platziert. Die
Erhebungder Datensätze erfolgte mit einem 4-7 MHz Konvex- oder einem 9-12 MHz
Linearschallkopfmit Aufsatz und Sensor.
Insgesamt konnten 194 Rohdatensätze erhoben werden, durchschnittlich 3,7 Datensätzen
proPatient. Die Ausprägung der Artefakte und die Bildbearbeitungsqualität wurden in Stufen
einsbis sechs eingeteilt. Die Verteilung aller Datensätze ist sowohl für die Artefakte als auch
fürdie Bildbearbeitungsqualität annährend normal. Von den 14 Datensätzen, die nach
Euthanasieangefertigt wurden, zeigte kein Datensatz hochgradige Artefakte. Von den 133
Datensätzen,die am wachen Patienten angefertigt wurden, zeigten ca. 20 % der erhobenen Daten
keineoder geringgradige Artefakte, während 30,8 % hochgradige Artefakte und damit nicht
weiterauswertbare Rohdaten aufwiesen. Von 47 in Narkose erstellten Datensätzen zeigten 12,7
%keine oder geringgradige Artefakte, während bei 2,1 % hochgradige Artefakte auftraten.
BeiAuftreten von Artefakten kann die Datensatzerstellung beliebig häufig wiederholt
werden.Mit Hilfe der weiteren Bildbearbeitung können fokale Veränderungen in allen Ebenen,
vorallem in der sonst nicht sichtbaren coronaren Ebene, eingesehen werden. Durch
verschiedeneWahlmöglichkeiten in der transparenten Darstellung ist es möglich, auch weniger
deutlicheParenchymveränderungen zu erkennen und hervorzuheben. Durch unvorsichtigen Einsatz
derParameter Threshold und Opacity können so genannte Rendering-Artefakte entstehen.Durch zu starke Nachbearbeitung kann es so zum Verlust von Informationen kommen.Die Volumetrie konnte bei 24 Patienten mit 94 Rohdatensätzen durchgeführt werden. 51 %der Patienten standen aufgrund von hochgradigen Artefakten, zu kleinem Scan odermangelndem Sensor nicht zur Messung zur Verfügung. Nach Einteilung der Läsionen in dreiFormkategorien zeigte sich ein signifikanter Unterschied der Messergebnisse für elliptischeFormen. Im Mittel waren diese 2D-Messungen um 24,7 % kleiner als die 3D-Messungen undes konnte mit p=0,0079 ein hoch signifikanter Wert festgestellt werden. Für alle Formenwaren die 2D-Messungen im Mittel um 15,6 % kleiner als die 3D-Messungen. Die 3DVolumetrie ist der 2D-Messung
und Berechnung nach der Ellipsoidformel vorzuziehen.Die Erstellungszeit eines Rohdatensatzes
betrug ca. 4,5-5 Sekunden, die Berechnung desDatensatzes erforderte ca. 25-30 Sekunden. Für die
Nachbearbeitung eines Rohdatensatzesmussten durchschnittlich 8,2 Minuten eingerechnet
werden.
Die Lage der Läsion im Parenchym hat einen signifikanten Einfluss auf die Ausprägung
vonArtefaktstufen und Bildbearbeitungsqualität. Die häufigsten Läsionen waren mit 51 %
imlinken Leberlappen lokalisiert und zeigten eine gute Auswertbarkeit. Dahingegen lag
beizwerchfellnahen Herden eine schlechte Bearbeitungsqualität vor.
Durch die dreidimensionale Sonographie war keine Aussage über die Dignität von
Läsionenmöglich.
Mit der 3D-Sonographie bietet sich eine kostengünstige Möglichkeit zur exakten
Volumenbestimmung, z. B. während einer Tumortherapie. Mit relativ geringem Aufwand kann aufdiese
Weise das Wachstum von fokalen Zubildungen in der Leber oder auch der Erfolg einerChemotherapie
anhand der Regression des Tumors frühzeitig festgestellt werden, da beikooperativen Patienten
und erfahrenem Untersucher eine Narkose nicht unbedingt notwendigist.
6 Summary
Three-dimensional sonography has been used in various disciplines of human medicine sincethe end of the 80s of the last century. Whereas in gynaecology surface imaging is used for thediagnosis of foetal deformities, an exact volumetry based on sensor technology is helpful inoncological follow-up examinations. In veterinary medicine its possible use in large and smallanimals has been under investigation for some time. With no exact details available hithertoconcerning the use of 3D-sonography of the liver, this paper is meant as pure research.The ultrasound scans for this study were carried out with the LOGIQ 9 equipment of GeneralElectric (GE). As radiographic technique a positional sensor used freehand was chosen, asprocessing programme the TRU 3D was available. Within the framework of this study 49dogs with alterations in the liver were sonographically examined. The ages of the patientswere between 2 and 15 years, the average being 10.24 years. Distribution according to sexamounted to 27 males and 22 females. Multiple alterations were observed in the patients, e.g.tumours (n=37), cysts (n=5) and calcifications (n=2). 4 patients’ livers showed an extremeinhomogeneity. In addition, one patient presented an alteration of the gall-bladder(mucoceles). With 24 patients ultrasound-pinpointed samples (biopsies) were taken from thealterations and subjected to follow-up cytological or pathological-histological assessment.First evaluations were carried out with 3 euthanized animals in order to check the researcher’sinfluence on the quality of the image. Afterwards sets of 3D raw data were acquired from 34patients in the waking state and 9 patients under anaesthetic. 3 patients were able to beexamined both under anaesthetic and without anaesthetic. All the acquired data wereexamined as to the different grades of quality of 3D specific artefacts, e.g. acquisitional artefacts, and as to the available quality of image processing (Multiplanar Reformation, Transparent Representation, Volumetry). The influence of the localization of lesions onfurther image processing was also checked. In addition, 24 patients were submitted tocomparative measurement of 2D-calculation by ellipsoid formula and of 3D-volumetry(Serial Method) with regard to foci. The measurement of the time needed for assembling andprocessing the data sets of some of the patients (n=10) was effected by means of of a spotsurvey.
The dogs were examined in a fasting state, in dorsal recumbency and with their
belliesshaved. The magnet necessary for the examination was placed level with the liver. The
datasets were obtained with the help of a 4-7 MHz convex or a 9-12 MHz linear transducer withattachment and sensor. Altogether, 194 sets of raw data were able to be obtained, 3.7 perpatient on average. The quality of the artefacts and of the image processing was divided
into six grades. The distribution of all the recorded data is
approximately normal with regard to theartefacts as well as to the quality of image processing.
Of the 14 sets of data drawn up aftereuthanasia, none displayed extreme artefacts. 20 % of the
133 data-sets obtained with patientsin the waking state showed no or insignificant artefacts,
with another 38 % being extremeartefacts, i.e. raw data unable to be further evaluated. 12.7 %
of the 47 records obtained underanaesthetic displayed no or insignificant artefacts, with
another 2.1 % of them being extremeones. If artefacts appear, the assembly of data can be
repeated as often as desired.
With the aid of further image processing, focal alterations at all levels can be observed,especially at the otherwise not visible coronary level. Different setting options of transparentimaging make it possible moreover to recognize and highlight even less distinctparenchymatic alterations. Incautious use of the parameters "Threshold" and "Opacity" maycause the formation of so-called Rendering-Artefacts. Over-enhancement may thus lead to aloss of some pieces of information.
94 sets of raw data were able to be
obtained by volumetry in 24 patients. The data of 51 % ofthe patients were not available for
measurement due to extreme artefacts, too small scans oran inadequate sensor. After dividing the
lesions into 3 shape-categories, a significantdifference in the measurement results of
elliptical shapes could be seen. On average, these 2Dmeasurements were 24.7 % smaller than the
3D ones, with p=0,0079 being a highlysignificant result. For all shapes, the 2D-measurements
were 15.6 % smaller than the 3D oneson average. Therfore 3D-volumetry is preferable to
2D-measurement and calculation usingthe ellipsoid formula.
The time needed to obtain a set of raw
data amounted to 4.5–5 seconds, the calculation of thedata to 25–30 seconds. On average, it took
8.2 minutes to process a set of crude data.The situation of the lesion in the parenchyma
influences significantly the grades of quality ofartefacts and quality of image processing. Most
frequently, lesions were to be found in the lefthepatic lobe (51 %), where they could be easily
evaluated. On the other hand, foci situatedclose to the diaphragm evinced a poor quality of
processing.Three–dimensional sonography did not permit a judgement on the benignity or malignity
oflesions.
3D-sonography offers an inexpensive possibilty of determining volumes exactly, e.g.
duringthe course of tumour therapy. In this way, the additional growth of foci in the liver or
theregression of the tumour by successful application of chemotherapy can be ascertained
earlyand without great expenditure of time or money, since with co-operative patients and
anexperienced examiner anaesthesia is not absolutely necessary.
7 Literaturverzeichnis
Ascenti, G.; Zimbaro, G.; Mazziotti, S.; Visalli, C.; Lamberto, S.; Scribano, E.;
Gaeta,
M. (2000)
Intrahepatic portal vein aneurysm: Three-dimensional power doppler demonstration infour cases.Abdominal Imaging, 26:520-3
Bailey, J.E.; Bude, R.O.; Tuthill, T.
(2001)
US
Artifacts: Effects on out-of-plane US images reconstructed from three-dimensionaldata
sets.Radiology, 218:592-7
Barr, F.
(1992)
Leber und
Milz.In: Barr, F.Ultraschalldiagnostik bei Hund und Katze, 21-38.Gustav Fischer Verlag, Stuttgart, Jena, New York
Bega, G.; Kuhlmann, K.; Lev-Toaff, A.; Kurtz, A.; Wapner, R.
(2001)
Application of three-dimensional ultrasonography in the evaluation of the fetal heart.J Ultrasound Med, 20:307-13
Brandl, H.; Gritzky, A.; Haizinger, M.
(1999)
3D
ultrasound: A dedicated system.Eur Radiol, 9:331-3Springer-Verlag, Hamburg
Braun, B.
(1992a)
Billäres
System.In: Braun, B.; Günther, R.; Schwerk, W.B.Ultraschalldiagnostik – Lehrbuch und Atlas, 12. Erg.Lfg., III 1.1, 17Ecomed Verlagsgesellschaft mbH, Landsberg, München,
Zürich
Braun, B. (1992b)
Schilddrüse.In: Braun, B.; Günther, R.; Schwerk, W.B.Ultraschalldiagnostik – Lehrbuch und Atlas, 11. Erg.Lfg., III 3.1, 8-11Ecomed Verlagsgesellschaft mbH, Landsberg, München, Zürich
Braun, U. (1997)
Leber.In:
Braun, U.Atlas und Lehrbuch der Ultraschalldiagnostik beim Rind, 35-66.Parey Buchverlag, Berlin, Stuttgart
Brunner, E.; Langer, F.
(1999)
Test auf
gemusterten Gruppeneffekt bei Versuchsanlagen für mehrere Gruppen mitabhängigen
Messwiederholungen.In: Brunner, E.; Langer, F.Nichtparametrische Analyse longitudinaler Daten, 91, 115, 142-4Oldenburg-Verlag, München
Burk, R.L.; Ackermann, N.
(1996)
The
abdomen.In: Burk, R.L.; Ackermann, N.Small Animal Radiology and Ultrasonography, a Diagnostic Atlas and Test,2nd Edition, 262-77.W.B. Saunders Company, Philadelphia, London
De Rycke, L.; Van Bree, H.; Simoens; P.
(1999)
Ultrasound-guided tissue-core biopsy of liver, spleen and kidney in normal dogs.Veterinary Radiology & Ultrasound, 40:294-9
Dobrinski, W.; Kremer, H. (1988)
Physikalische und technische Grundlagen.In: Dobrinski, W.; Kremer, H.Sonographische Diagnostik, 3-9Urban und Schwarzenberg, München, Wien, Baltimore
Downey, D.B.; Fenster, A.; Williams, J.C.
(2000)
Clinical
utility of three-dimensional US.Imaging & Therapeutic Technology, RadioGraphics;
20:559-71
Dudwiesus, H. (1995)
Physikalische Grundlagen.In: Sohn, C.; Holzgreve, W.Ultraschall in der Gynäkologie und Geburtshilfe, 5-26Verlag Georg Thieme, Stuttgart
Edinger, J.; Koneberg, D.
(2001)
Möglichkeiten der 3D-Sonographie in der Gelenkdiagnostik bei Pferden.Ultraschall in der Medizin, 22:71
Elliot, T.L.; Downey, D.B.; Tong, S.; McLean, C.A.; Fenster, A.
(1996)
Accuracy
of prostate volume measurements in vitro using three-dimensionalultrasound.Acad Radiol, 3:401-6
Farrar, E.T.; Washabau, R.J.; Saunders, H.M.
(1996)
Hepatic
abscesses in dogs: 14 cases (1982-1994).J Am Vet Med Assoc, 208:243-7
Fenster, A.; Downey, D.B.
(2003)
Three-dimensional ultrasound imaging and its use in quantifying organ and pathologyvolumes.Anal Bioanal Chem, 377:982-9
Gerwing, M. (1989)
Sonographische Darstellung von Milz und Prostata des Hundes unter besondererBerücksichtigung der Messung ihrer Lage und Größe sowie des sonographischenBildes der pathologischen Veränderung. Das Hydroperitoneum zur besserenDifferenzierung abdominaler Organe.Vet. Diss. Giessen
Gerwing, M. (1993a)
Physikalische und technische Grundlagen der Sonographie.In: Fritsch, R.; Gerwing, M.Sonographie bei Hund und Katze, 2-27Enke-Verlag, Stuttgart
Gerwing, M.
(1993b)
Spezielle
Untersuchungstechnik und Organdarstellung, Leber.In: Fritsch, R.; Gerwing, M.Sonographie bei Hund und Katze, 125-7Enke-Verlag, Stuttgart
Gilja, O.H.; Hausken, T.; Berstad, A.; Odegaard, S.
(1999)
Measurements of organ volume by ultrasonography.Proc Inst Mech Eng, 213(3):247-59
Gladisch, R.
(1992)
Einführung in die sonographische Diagnostik.In: Gladisch, R.Praxis der abdominellen Ultraschalldiagnostik, 2-28Schattauer-Verlag, Stuttgart
Grenacher, L.; Thorn, M.; Knaebel, H.P.; Vetter, M.; Hassenpflug, P.; Kraus, T.;
Meinzer, H.P.; Büchler, M.W.; Kauffmann, G.W.; Richter, G.M.
(2005)
Bedeutung
der 3-D-Bildgebung und computerbasierten Nachverarbeitung für dieChirurgie der Leber und des
Pankreas.Fortschr Röntgenstr, 177:1219-26
Hausken, T.; Leotta, DF.; Helton, S.; Kowdley, K.V.; Goldman, B.; Vaezy, S.;
Bolson,
E.L.; Sheehan, F.H.; Martin, R.W. (1998)
Estimation of the human liver volume and configuration using three-dimensionalultrasonography: Effect of a high-caloric liquid meal.Ultrasound in Medicine and Biology, 24:1357-67
Hittmair, K. (1997)
Fehlermöglichkeiten der sonographischen Organdiagnostik.In: Hittmair, K.Ultraschall in der Kleintierpraxis, 52-94Enke-Verlag, Stuttgart
Kaarmann, H.; Wessels, G.
(1991)
Physikalische Grundlagen.In: Braun, B.; Günther, R.; Schwerk, W.B.Ultraschalldiagnostik - Lehrbuch und Atlas, 10. Erg.Lfg., II 1, 1-35Ecomed Verlagsgesellschaft mbH, Landsberg, München, Zürich
Kessler, M.
(2005)
Kleintieronkologie, Vorwort.Parey Buchverlag, Berlin, Stuttgart
Knauff, P.S.
(1987)
Sonographische Darstellung von Nieren, Ureteren und Harnblase beim Hund unterbesonderer Berücksichtigung der Messung ihrer Lage, Größe und ihres Inhaltes.Vet. Diss. Giessen
Köstering, B.; Jost-Köstering, S.; Dudwiesus, H.
(2002)
Dreidimensionaler Ultraschall (3D).In: Kramme, R.Medizintechnik, 176-9Springer-Verlag, Hamburg
Lamb, C. (1995)
Abdominal ultrasonography in small animals.In: Goddard, P.J.Veterinary Ultrasonography, 21-41Cab International, Wallingford UK
Lamb, C. (1998)
Ultrasonography of portosystemic shunts in dogs and cats.The Veterinary Clinics of North America-Small Animal Practice, 28:725-53W.B. Saunders Company, Philadelphia
Lang, H.; Wolf, GK.; Prokop, M.; Nuber, B.; Weimann, A.; Raab, R.; Zoller, W.G.
(1999)
Dreidimensionale Sonographie zur Volumenbestimmung von Lebertumoren- ein ersterErfahrungsbericht.Der Chirurg, 70:246-50
Leppek, R.; Klose, K.J.
(1995)
3D-Darstellung der Leber.Der Radiologe, 35:769-77
Li, J.; Sanders, SP.
(1999)
Three-dimensional echocardiography in congenital heart disease.Curr Opin Cardiol, 14:53-9
Ließ, H.; Roth, C.; Umgelter, A.; Zoller, W.G.
(1994)
Improvements in volumetric quantification of circumscribed hepatic lesions by threedimensional sonography.Gastroenterol 32:488
Mattoon, J.S.; Pennick, D.G.; Wisner, E.R.; Nyland, T.G.; Auld, D.M. (2002)
Advanced techniques and future trends.In: Nyland, T.G.; Mattoon, J.S.Small Animal Diagnostic Ultrasound, 2nd edition, 425-40W.B. Saunders Company, Philadelphia
Michele, U. (2000)
Die
Sonographie des Ellbogengelenkes und seines Weichteilmantels beim gesundenerwachsenen
Hund.Vet. Diss. Giessen
Monteagudo, A.; Timor-Tritsch, IE.; Mayberry, P.
(2000)
Three-dimensional transvaginal neurosonography of the fetal brain: “navigating” inthe volume scan.Ultrasound Obstet Gynecol, 16:307-13
Nadkarni, SK.; Boughner, DR.; Drangova, M.; Fenster, A.
(2000)
Three-dimensional echocardiography: assessment of inter- and intra-operatorvariability and accuracy in the measurement of left ventricular cavity volume andmyocardial mass.Phys Med Biol, 45:1255-73
Nelson, T.R.; Pretorius, D.H.; Hull, A.; Riccabona, M.; Sklansky, M.S.; James, G.
(2000)
Sources
and impact of artifacts on clinical three-dimensional ultrasound imaging.Ultrasound Obstet
Gynecol, 16:374-83
Nickel, R.; Schummer, A.; Seiferle, E.
(2004)
Darmanhangsdrüsen von Hund und Katze.In: Nickel, R.; Schummer, A.; Seiferle, E.Lehrbuch der Anatomie der Haustiere, Band 2, 9. unveränderte Auflage, 155Verlag Parey, Berlin, Hamburg
Nyland, T.G.; Mattoon, J.S.; Herrgesell, E.J.; Wisner, E.R. (2002a)
Ultrasound-guided biopsy.In: Nyland, T.G.; Mattoon, J.S.Small Animal Diagnostic Ultrasound, 2nd edition, 30-48W.B. Saunders Company, Philadelphia
Nyland, T.G.; Mattoon, J.S.; Herrgesell, E.J.; Wisner, E.R.
(2002b)
Liver.In:
Nyland, T.G.; Mattoon, J.S.Small Animal Diagnostic Ultrasound, 2nd edition, 93-127W.B. Saunders Company, Philadelphia
Partington, B.P.; Biller, D.S.
(1996)
Liver.In:
Green, R.W.Small Animal Ultrasound, 105-30Lippincott-Raven Publisher, Philadelphia
Peppler, C.; Kramer, M.; Gerwing, M.; Michele, U.
(2005)
Sonographie der Leber bei Hund und Katze.Praktischer Tierarzt, 86:14-21
Polaków, J.; Janica, J.; Serwatka, W.; Ladny, J.R.; Zukowska-Serwatka, K.
(2003)
Value of
three-dimensional sonography in biopsy of focal liver lesions.J Hepatobiliary Pancreat Surg,
10:87-9
Pooh, R.K.; Pooh, K.
(2001)
Transvaginal 3D and doppler ultrasonography of the fetal brain.Semin Perinatol, 25:38-43
Poulsen Nautrup, C. (2001)
Dreidimensionale Sonographie.In: Poulsen Nautrup, C.; Tobias, R.Atlas und Lehrbuch der Ultraschalldiagnostik bei Hund und Katze, 381-90Schlütersche, Hannover
Poulsen Nautrup, C. (2004)
Dreidimensionale Echokardiographie bei Hunden und Katzen.Ultraschall in der Medizin, 25:90
Reef, V. (1998)
Adult
abdominal ultrasonography.In: Reef, V.Equine Diagnostic Ultrasound, 279:304-15.W.B. Saunders Company, Philadelphia
Rettenmaier, G; Seitz, K.
(1994)
Fokale
Leberveränderungen.In: Rettenmaier, G.; Seitz, K.Sonographie Differentialdiagnostik, 89, 110Chapman & Hall; London, Glasgow
Riccabona, M; Nelson, T.R.; Pretorius, D.H.
(1996)
Three-dimensional ultrasound: accuracy of distance and volume measurements.Ultrasound in Obstetrics & Gynecology, 7:429-34
Rose, S.C.; Andre, M.P.; Roberts, A.C.;Kinney, T.B.; Valji, K.; Ronaghi, A.;
Hassanein,
T.I.; Lavine, J.E.; Hart, M.E.; Khanna, A.
(2001a)
Integral
role of interventional radiology in the development pediatric livertransplantation
program.Pediatr Transplant, 5:331-8
Rose, S.C.; Hassanein, T.I.; Easter, D.W.; Gamagami, R.A.; Bouvet, M.; Pretorius,
D.H.; Nelson, T.R.; Kinney, T.B.; James, G.M. (2001b)
Value of
three-dimensional US for optimizing guidance for ablating focal liver tumors.J Vasc Interv
Radiol, 12:507-15
Sakas, G.; Walter, S.; Grimm, M.; Richtscheid, M.
(2000)
Freihandakquisition, Rekonstruktion und Visualisierung von 3D- und 4D-Ultraschall.Der Radiologe, 40:295-303
Scharf, A.; Ghazwiny, M.F.; Steinborn, A.; Baier, P.; Sohn, C.
(2001)
Evaluation of two-dimensional versus three-dimensional ultrasound in obstetricdiagnostics: A prospective study.Fetal Diagn Ther, 16:333-41
Scharf, A.; Sohn, C.
(2002)
Dreidimensionale Ultraschalldarstellung und andere neue Technologien inGynäkologie und Geburtshilfe.In: Sohn, C; Tercanli, S.; Holzgreve, W.Ultraschall in Gynäkologie und Geburtshilfe, 787-808Verlag Georg Thieme, Stuttgart
Schuler, A.; Börner, N.
(2001)
Leber.In:
Braun, B.; Günther, R.; Schwerk, W.B.Ultraschalldiagnostik – Lehrbuch und Atlas, 22. Erg.Lfg.,
III 1.2, 1-190Ecomed Verlagsgesellschaft mbH, Landsberg, München, Zürich
Schwarz, L.A.; Pennick, D.G.; Leveille-Webster, C
(1998)
Hepatic
abscesses in 13 dogs: a review of the ultrasonographic findings, clinical dataand therapeutic
options.Veterinary Radiology & Ultrasound,
39:357-65
Selcer, B.A. (1995)
The liver and gallbladder.In: Cartee, R.E.; Selcer, B.A.; Hudson, J.A.; Finn-Bodner, S.T.; Mahaffey, M.B.;Johnson, P.L.; Marich, K.W.Practical Veterinary Ultrasound, 88-106Williams and Wilkins, Philadelphia
Sohn, C; Grotepaß, J.; Schneider, W.; Sohn, G.; Funk, A.; Jensch, P.; Fendel, H.;
Ameling, W.; Jung, H. (1988)
Dreidimensionale Darstellung in der Ultraschalldiagnostik.Dtsch Med Wochenschr 45:1743-7
Strohm, W.-D.; Gladisch, R.
(1992)
Leber.In:
Gladisch, R.Praxis der abdominellen Ultraschalldiagnostik, 82-122Schattauer–Verlag, Stuttgart
Strommen, K.; Stormark, T.A.; Iversen, B.M.; Matre, K.
(2004)
Volume
estimation of small phantoms and rat kidneys using three-dimensionalultrasonography and a
position sensor.Ultrasound Med Biol, 30:1109-17
Stünzel, K.
(1994)
Zielorgan
Leber.In: Stünzel, K.Abdominelle Sonographie bei Hund und Katze, 124-8Verlag Medicus–Partner, Budapest
Suematsu, Y.; Takamoto, S.; Kaneko, Y.; Ohtsuka, T.; Takayama, H.; Kotsuka, Y.;
Murakami, A.
(2003)
Beating
atrial septal defect closure monitored by epicardial real-time threedimensional echocardiography without cardiopulmonary bypass.Circulation, 107:785-90
Tokuno, H.; Chiken S. (2004)
Three-dimensional ultrasonography of monkey brain.Neurosci Res, 49:133-8
Tong, S.; Cardinal, H.N.; McLoughlin, R.F.; Downey, D.B.; Fenster, A.
(1998)
Intra-
and inter-observer variability and reliability of prostate volume measurement viatwo-dimensional
and three-dimensional ultrasound imaging.Ultrasound Med Biol, 24:673-81
Treece, G.; Prager, R.; Gee, A.; Berman, L.
(2001)
3D
ultrasound measurement of large organ volume.Med Image Anal, 5:41-54
Tucker De Sanctis, J.; Hahum Goldberg, S.; Mueller, P.R.
(1998)
Percutaneous treatment of hepatic neoplasms: A review of current techniques.Cardiovasc Intervent Radiol, 21:273-96
Wagels, R.; Stadler, P.
(2004)
Sonographische Sehnenuntersuchung mit Hilfe des Panoramabildverfahrens und derdreidimensionalen Darstellung.Ultraschall in der Medizin, 25:83
Wagner, S.; Gebel, M.; Bleck, J.S.; Manns, M.P.
(1994)
Clinical
application of three-dimensional sonography in hepatobiliary disease.Bildgebung, 61:104-9
Wang, K.; Panciera, D.; Al-Rukibat, R.K.; Radi, Z.A.
(2004)
Accuracy
of ultrasound-guided fine-needle aspiration of the liver and cytologicfindings in dogs and cats:
97 cases (1990-2000).J Am Vet Med Assoc,
224:75-8
Wong, J.; Gerscovich, E.O.; Cronan, M.S.; Seibert, J.A. (1996)
Accuracy and precision of in vitro volumetric measurements by three-dimensionalsonography.Invest Radiol, 31:26-9










Share this article / Teilen Sie diesen Artikel
Diese Webseite wurde mit Jimdo erstellt! Jetzt kostenlos registrieren auf https://de.jimdo.com